電子配置
|
|
「シュレーディンガー方程式」を解くことにより、原子内における電子の収まり方が明らかになりました。 電子は、原子核のまわりを自由に動いているのではなく、決められた空間(電子殻)に分布しています。 内側の電子殻から順番に入っていき、いっぱいになったら1つ外側の電子殻に入っていきます。 このパターンだと、原子番号19のカリウムは周期表の第3周期になるはずなのですが、実際には第4周期です。 一体、なぜ? 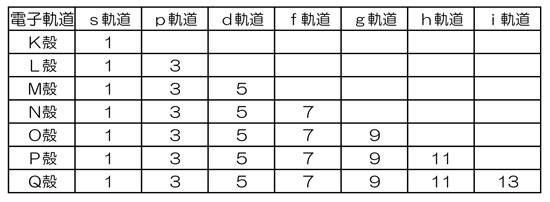 学ぶ項目を、ステップを細かく分けて一覧にしました。 「この項目は大丈夫だな。」と思うものは飛ばしてもらって結構です。 自分に必要な項目だけを学べば良いでしょう。 カッコ内は、文部科学省の学習指導要領に従った、目安となる履修学年です。 【構成原理】・・・電子殻への電子の入り方には決まりがあります。 (01)電子殻(高1)・・・なぜA殻からスタートしないで、K殻からスタートしているのでしょうか? (02)最大収容電子数(高1)・・・n番目の電子殻には「2n2」個の電子が入れます。 (03)電子の軌道・・・n番目の電子殻にはn種類の電子軌道があります。 (04)ヴォルフガング・パウリ(1900−1958)・・・1925年に「パウリの排他律」を発表。 (05)パウリの排他律・・・それぞれの電子軌道には、電子が2個まで入れます。 (06)フリードリヒ・フント(1896−1997)・・・1927年に「フントの規則」を発表。 (07)フントの規則・・・最外殻への電子の入り方に関するルールです。 (08)構成原理・・・「パウリの排他律」と「フントの規則」を合わせて「構成原理」と言います。 【マーデルングの規則】・・・なぜ、カリウムは、第3周期ではなく、第4周期なのだろう? (09)アルゴンまで・・・「構成原理」に従った電子配置です。 (10)カリウム・・・19個目の電子が「3d軌道」ではなく、「4s軌道」に入っています。 なぜ? (11)エルヴィン・マーデルング(1881−1972)・・・1936年に「マーデルングの規則」を発表。 (12)マーデルングの規則・・・電子が軌道を埋めていく順序に関するルールです。 (※)原子番号20の「カルシウム」までは、学校でも覚えさせられます。 では、原子番号21の「スカンジウム」以降は、どうなっているのでしょうか? → こちら 「元素の周期表」に戻る |
|
|