モル濃度と電離度の関係
|
|
塩酸などの強酸では、水溶液中で100%電離していると見なせますが、 酢酸などの弱酸では、水溶液中で電離する分子が少なく、電離の度合いを「電離度」で示します。 高校化学で、「濃度が小さくなると電離度が大きくなる。」「濃度が大きくなると電離度が小さくなる。」と 学びますが、その根拠は? 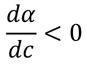 学ぶ項目を、ステップを細かく分けて一覧にしました。 「この項目は大丈夫だな。」と思うものは飛ばしてもらって結構です。 自分に必要な項目だけを学べば良いでしょう。 カッコ内は、文部科学省の学習指導要領に従った、目安となる履修学年です。 【モル濃度】 (01)アメデオ・アボガドロ・・・イタリアの化学者です。 「アボガドロ定数」に名を残しています。 (02)旧アボガドロ定数・・・6.02214076・・・×1023個でした。 (03)新アボガドロ定数・・・6.02214076×1023個です。 2019年5月20日からスタート! (04)1モル(高1)・・・6.02214076×1023個分の量です。 (05)物質量(高1)・・・1モル分の量に対して、どれくらいあるかを示した数量です。 (06)モル濃度(高1)・・・溶液1リットルあたりに溶けている溶質の物質量です。 【質量作用の法則】 (07)プロパンガスの燃焼・・・完全燃焼させると、二酸化炭素と水が生成します。 (08)不可逆反応(高2)・・・二酸化炭素と水からプロパンガスは生成しません。 (09)可逆反応(高2)・・・一方通行の反応ではなく、両方向の反応が起こります。 (10)平衡状態(高2)・・・両方向の反応速度が同じになり、見掛け上、各物質の量に変化がない状態です。 (11)平衡定数(高2)・・・「質量作用の法則」における定数です。 【pH】 (12)電離平衡(高2)・・・電離による平衡状態です。 (13)水の電離平衡(高2)・・・水も非常にわずかですが電離し、水素イオンと水酸化物イオンが生成。 (14)水のイオン積(高2)・・・(水素イオンのモル濃度)×(水酸化物イオンのモル濃度)=(一定)。 (15)水素イオン濃度(高2)・・・水素イオンのモル濃度を、液性の指標として考えました。 (16)常用対数(高2)・・・そのまま用いるには値が小さすぎるので、常用対数をとることにしました。 (17)水素イオン指数(高2)・・・負の値だとややこしいので、マイナス1を掛けて仕上げました。 (18)pH(中3)・・・「水素イオン指数」のことです。 「 Potential Hydrogen 」の略称です。 (19)中性のpH(中3)・・・25℃では「7」になります。 (20)酸性のpH(中3)・・・25℃では「7」より小さくなります。 (21)塩基性のpH(中3)・・・25℃では「7」より大きくなります。 【電離度】 (※)事前に、「微分法」について学んでおくと良いです。 → こちら (22)濃度と電離度の関係・・・濃度が非常に小さくなると、電離度は無視できない大きさになります。 「酸と塩基」に戻る |
|
|