僼傽儞僩儂僢僼偺幃
|
|
乽婥懱偺忬懺曽掱幃乮俹倁亖値俼俿乯乿偵偍偄偰丄乽俼乿偼乽婥懱掕悢乿側偺偱丄尦乆丄掕悢偱偡丅 枾暵梕婍撪偱偺尰徾傪峫偊傞偲丄乽倁乮懱愊乯乿傕堦掕偲尒側偟偰椙偄偱偟傚偆丅 偲偄偆偙偲偼丄乽値乮暔幙検乯乿偑堦掕側傜丄乽俹乮埑椡乯乿偲乽俿乮愨懳壏搙乯乿偼斾椺娭學偵側傝傑偡丅 偟偐偟丄忲婥埑嬋慄傪尒傞尷傝丄僌儔僼偼捈慄偱側偄偺偱丄斾椺娭學偱偼偁傝傑偣傫丅 俿偑戝偒偔側傞偵偮傟偰丄僌儔僼偺孹偒偑媫偵側偭偰偄傞丒丒丒偲偄偆偙偲偼丄 俿偑戝偒偔側傞偵偮傟偰丄値傕戝偒偔側偭偰偄傞丒丒丒偲偄偆偙偲偵側傝傑偡丅 壏搙偑忋徃偡傞偲丄戝偒側僄僱儖僊乕傪傕偮暘巕偺悢偑憹壛偡傞偐傜偱偡丅 掕惈揑側夝庍側傜丄偙偺掱搙偱椙偄偱偟傚偆偐丅 偟偐偟丄掕検揑偵棟夝偟傛偆偲巚偊偽丄偡側傢偪丄忲婥埑嬋慄傪昤偙偆偲巚偊偽丄 嬶懱揑側娭悢傪抦傞昁梫偑偁傝傑偡丅丒丒丒偝偰丄偳偆偟傑偟傚偆丠 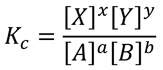 妛傇崁栚傪丄僗僥僢僾傪嵶偐偔暘偗偰堦棗偵偟傑偟偨丅 乽偙偺崁栚偼戝忎晇偩側丅乿偲巚偆傕偺偼旘偽偟偰傕傜偭偰寢峔偱偡丅 帺暘偵昁梫側崁栚偩偗傪妛傋偽椙偄偱偟傚偆丅 僇僢僐撪偼丄暥晹壢妛徣偺妛廗巜摫梫椞偵廬偭偨丄栚埨偲側傞棜廋妛擭偱偡丅 亂僊僽僘僄僱儖僊乕乮俧乯亃 乮侽侾乯擬椡妛戞侾朄懃乮崅侾乯丒丒丒擬検俻傪梌偊傞偲丄撪晹僄僱儖僊乕偑嚈倀曄壔偟丄奜偵懳偟偰倂偺巇帠丅 乮侽俀乯巇帠乮倂乯丒丒丒堦掕偺埑椡俹偱懱愊偑嚈倁曄壔偟偨偲偡傞偲丄倂亖俹嚈倁丅 乮侽俁乯擬検乮俻乯丒丒丒堦掕偺壏搙俿偱擬検俻傪梌偊偨偲偒丄僄儞僩儘僺乕偑嚈俽曄壔偟偨傜丄俻亖俿嚈俽丅 乮侽係乯帺慠側曄悢丒丒丒娭學幃偑娙扨偵側傞曄悢偺偙偲丅丂忋婰偺応崌丄倁偲俽偵側傝傑偡丅 乮侽俆乯曄悢俹偲俿丒丒丒幚嵺偵偼丄俹偲俿傪曄悢偵偟偨曽偑尰幚揑偱偡丅 乮侽俇乯僂傿儔乕僪丒僊僽僘丒丒丒傾儊儕僇偺暔棟壔妛幰丅丂乽僊僽僘僄僱儖僊乕乿傪峫偊傑偟偨丅 乮侽俈乯僊僽僘僄僱儖僊乕丒丒丒乽俧亖倀亄俹倁亅俿俽乿側傞傕偺傪掕媊偡傞偲丄俹偲俿偑帺慠側曄悢偵側傞丅 乮侽俉乯旕婡夿揑巇帠丒丒丒壔妛斀墳偵傛傞僄僱儖僊乕検偼丄僊僽僘僄僱儖僊乕偺憹尭検偵摍偟偄偱偡丅 亂壔妛億僥儞僔儍儖乮兪乯亃 乮侽俋乯壔妛億僥儞僔儍儖丒丒丒撪晹僄僱儖僊乕偺曄壔検偑暔幙検偺曄壔検偵斾椺偡傞偲偒偺斾椺掕悢偱偡丅 乮侾侽乯懡惉暘宯丒丒丒宯傪峔惉偡傞暔幙偼丄侾偮偲偼尷傜側偄偺偱丄懡惉暘偺偲偒傕峫偊傑偡丅 乮侾侾乯兪偲俧偺娭學丒丒丒乮壔妛億僥儞僔儍儖乯亖乮侾儌儖偁偨傝偺僊僽僘僄僱儖僊乕乯偱偡丅 亂梟塼偲婥憡偺暯峵亃 乮侾俀乯儌儖暘棪乮崅俀乯丒丒丒懡惉暘宯偵偍偄偰丄偁傞惉暘偑愯傔傞暔幙検偺妱崌偱偡丅 乮侾俁乯棟憐崿崌僄儞僩儘僺乕丒丒丒僄儞僩儘僺乕傪丄乽儌儖暘棪乿偲乽婥懱掕悢乿偱昞偟傑偡丅 乮侾係乯崿崌婥懱偺僊僽僗僄僱儖僊乕丒丒丒俀庬椶偺婥懱傪巇愗傞傕偺傪庢傝彍偔偲帺慠偵崿偞傞偺偼丄側偤丠 乮侾俆乯棟憐梟塼偺俧丒丒丒棟憐婥懱偲摨偠傛偆側峫偊傪憐掕偟偨梟塼傪乽棟憐梟塼乿偲尵偄傑偡丅 乮侾俇乯棟憐梟塼偺兪丒丒丒崿崌慜偲丄崿崌屻偱丄壔妛億僥儞僔儍儖偼丄偳傟偩偗曄壔偟偨丠 乮侾俈乯梟塼偲婥憡偺暯峵丒丒丒塼懱偑婥懱拞偵忲敪偡傞偲偒傗婥懱偑梟塼偵梟偗傞偲偒丄偳偆側偭偰偄傞丠 亂僼傽儞僩儂僢僼偺幃亃 乮侾俉乯儎僐僽僗丒僼傽儞僩儂僢僼丒丒丒僆儔儞僟偺壔妛幰丅丂乽僼傽儞僩儂僢僼幃乿傪摫偒傑偟偨丅 乮侾俋乯僼傽儞僩儂僢僼偺幃丒丒丒壔妛斀墳偺暯峵掕悢偲愨懳壏搙偺娭學幃偱偡丅 乮俀侽乯埑暯峵掕悢乮崅俀乯丒丒丒楌巎揑偵偼屻偱偡偑丄偙偪傜偐傜擖偭偨曽偑棟夝偟傗偡偄偱偡丅 乮俀侾乯擹搙暯峵掕悢乮崅俀乯丒丒丒楌巎揑偵偼愭偱偡偑丄僼傽儞僩儂僢僼幃傪梟塼斀墳偵奼挘偟偨僀儊乕僕丅 乮俀俀乯壔妛暯峵偺朄懃乮幙検嶌梡偺朄懃乯乮崅俀乯丒丒丒暯峵掕悢偵娭偡傞幃偺偙偲偱偡丅 丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂乽崿崌暔偺暘棧乿偵栠傞 |
|
|