Effects
of natural convection (advantages of microgravity experiment);
対流の効果(微小重力実験の利点)
結晶周囲の「流れ」,「対流」は結晶の成長に大きな影響を及ぼします.その影響について,独断で下記にまとめてみました.
【対流のもたらす好影響】
成長している結晶の周囲には,溶質濃度が低下した領域ができます(depletion
zone: 枯渇帯,とも呼ばれます).その結果,結晶表面でのタンパク質濃度はバルク溶液に比べて低下してしまうため,その分結晶の成長速度が低下してしまいます.系内に対流による流れが存在すると,攪拌によって結晶周囲の枯渇帯がより浅く・小さくなるため,結晶成長速度の低下をある程度防ぐことができます.
工業的には,この様な状況を回避するため,通常は溶液内を「できるだけ均一になるように攪拌する」戦略が採られます.容器内を以下に効率よく攪拌するかは,特に工業晶析の分野では重要な研究テーマです.
しかしながら,タンパク質結晶は非常にもろいため,攪拌流によって結晶が壊れてしまいます.そこで,タンパク質結晶の場合には,次善の策として「できる限りそっと静置しておく」戦略が一般に採られます.
|
|
|
|
成長しているADP (ammonium dihydrogen phosphate)結晶の周囲にできた濃度分布.本写真では干渉縞は等濃度線を示す.溶液層の厚さ1.2mm,1g.図中の矢印は結晶-溶液界面を示す(S.
Miyashita, et al., J. Jpn. Soc. Microgravity Appl., 15 (1998) 577).
|
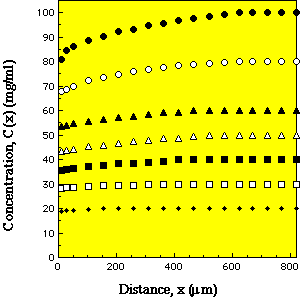
成長しているリゾチーム正方晶系結晶の周囲にできる濃度分布.バルク溶液中のタンパク質濃度が濃いほど結晶は速く成長するため,枯渇帯はより深く・大きくなる.(栗原和男:修士論文,東北大学理学研究科物理学専攻,1994;佐﨑ら,日本結晶成長学会誌,
23 (1996) 413. |
【対流のもたらす悪影響】
1)結晶周囲の「タンパク質(溶質)の濃度分布」に擾乱を及ぼす.
2)結晶周囲の「不純物の濃度分布」に擾乱を及ぼす.
3)溶液中のダスト粒子の結晶への付着・取り込みを促す.
4)流れによる結晶表面層の剥離や結晶同士の衝突により「二次核」を生成させる.
上記の効果は,全て結晶の品質を劣化させる働きがあります.言い換えると,「微小重力環境」(スペースシャトルや宇宙ステーションでの結晶成長実験)では,上記の悪影響を防ぐことができるため,良質の結晶が得られる可能性があります.また,微小重力環境では,上記の項目以外に,「結晶の自重や器壁への付着による結晶が歪む」ことも回避できます(無容器成長の効果).
【地上で対流が無視できる環境を作るには】
浮力対流をなくすには,非常に高価な微小重量環境を利用するしか方法がないわけではありません. 誰でも簡単にそのような環境を作り出してやることができます.その方法についても,最後に簡単に説明しました.
【ハンギング・ドロップ法とシッティング・ドロップ法の大きな違い】
蒸気拡散法で,この2つの方法はよく使われるものです.この両者には,ふつう大きな違いはないように思われていますが,それは大間違い.違いについて解説します.
(タンパク質結晶成長のトップページへ)
1)結晶周囲の「タンパク質(溶質)の濃度分布」に擾乱を及ぼす.
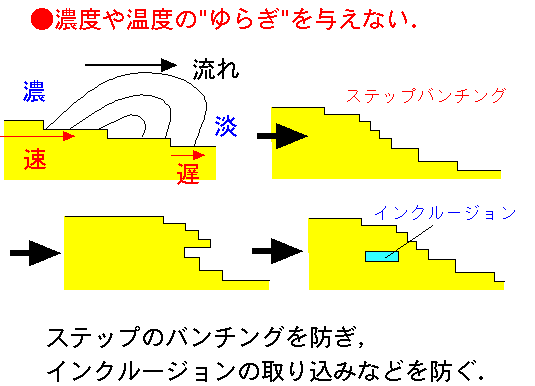 結晶の表面は,らせん成長や二次元核成長などによってできた多くのステップからなっています.そのため,結晶表面の断面は右図のように階段状になっており,これらは微斜面(Vicinal
face)と呼ばれます.先に,成長している結晶の周囲には,溶質の枯渇に伴う濃度分布ができると述べましたが,ここのステップについても同様の濃度分布ができます.
結晶の表面は,らせん成長や二次元核成長などによってできた多くのステップからなっています.そのため,結晶表面の断面は右図のように階段状になっており,これらは微斜面(Vicinal
face)と呼ばれます.先に,成長している結晶の周囲には,溶質の枯渇に伴う濃度分布ができると述べましたが,ここのステップについても同様の濃度分布ができます.
さて,この様な微斜面の上流から下流に向かって流れが存在すると,上流のステップは溶質濃度の濃い溶液と出会い速く前進しますが,下流のステップは溶質濃度の低い溶液としか出会えず前進速度が遅くなります.そのため上段のステップが下段よりも速く前進するため,ステップ同士が詰まってしまい,ステップのバンチング(束化)という現象がおこります.
これがさらに進行すると,ついに上段のステップが下段を追い越してしまい,オーバーハングした後,結晶化母液をインクルージョンとして取り込んでしまいます.この様な現象は,結晶の品質を低下させると考えられています.
【参考文献】Chernov, A.A.(ed.) (1984) Modern Crystallography III, Crystal Growth,
Springer, Berlin.
(対流の影響ページのトップへ)
2)結晶周囲の「不純物の濃度分布」に擾乱を及ぼす.
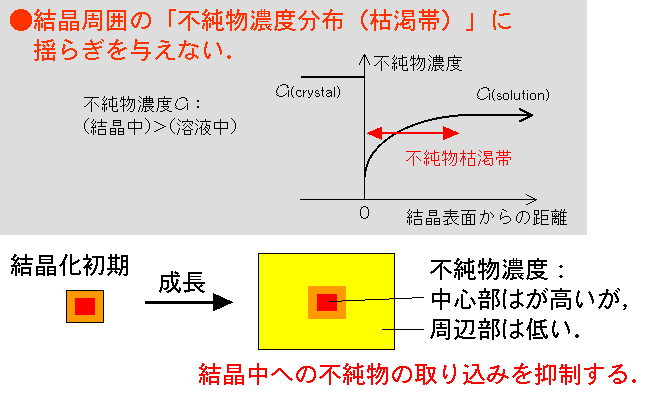
成長している結晶の周囲には,溶質であるタンパク質分子のみならず,不純物についても濃度分布が形成されます.例えば,溶液中よりも結晶中での方が不純物濃度が高い場合には(分配係数>1),不純物は選択的に結晶に取り込まれるため,結晶近傍ではバルク溶液中に比べて不純物濃度が低くなります.その結果,下図の下段に示したように,結晶化初期段階で結晶が多くの不純物を取り込んだ結果,結晶の周囲に不純物枯渇帯が形成され,それ以降は不純物濃度が低い結晶が育成されることになります.
不純物が目的タンパク質のオリゴマーであったり,より分子量の大きなタンパク質である場合には,本メカニズムは特に有効に働きます.不純物の拡散定数が目的タンパク質よりも小さい場合には,対流さへなければ,いったん形成された不純物枯渇帯はより有効に働くためです.(目的タンパク質のオリゴマーは,結晶成長に特に悪影響を及ぼす不純物です).
【参考文献】Chernovさんの最近の論文が適当です(すいません,すぐに適当なモノを探します).
(対流の影響ページのトップへ)
3)溶液中のダスト粒子の結晶への付着・取り込みを促す.
 タンパク質試料を結晶化させている溶液中には,
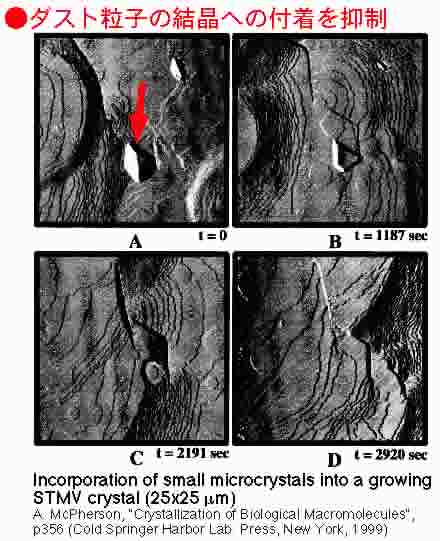
フィルターなどをかけてきれいにしているつもりでも,実際には非常に多数のゴミや微結晶などのダスト粒子が存在します.微小重力環境下では,溶液中に流れがないためにこれらのダスト粒子はじっとしていますが,対流の存在する系ではこれらの粒子は溶液中を活発に動き回り,結晶上へも頻繁に降ってきます.右図は,そのようなダスト粒子が,結晶状に付着した後,結晶中に取り込まれて行く様子をAFMで観察した様子です.この様なダスト粒子の取り込みが,結晶の品質に良い効果をもたらすはずがありません.
タンパク質試料を結晶化させている溶液中には,
フィルターなどをかけてきれいにしているつもりでも,実際には非常に多数のゴミや微結晶などのダスト粒子が存在します.微小重力環境下では,溶液中に流れがないためにこれらのダスト粒子はじっとしていますが,対流の存在する系ではこれらの粒子は溶液中を活発に動き回り,結晶上へも頻繁に降ってきます.右図は,そのようなダスト粒子が,結晶状に付着した後,結晶中に取り込まれて行く様子をAFMで観察した様子です.この様なダスト粒子の取り込みが,結晶の品質に良い効果をもたらすはずがありません.
(対流の影響ページのトップへ)
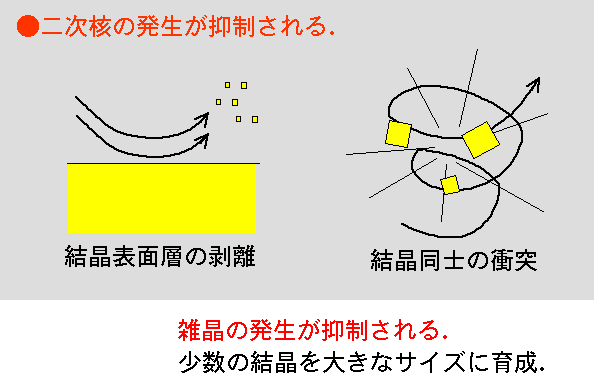
4)流れによる結晶表面層の剥離や結晶同士の衝突により「二次核」を生成させる.
タンパク質結晶は,先にも申しましたとおり非常にもろい結晶です.そのため,ある程度の流れが存在すると,流れによって結晶の表面層が剥離し,飛び散った剥離編が新たな微結晶の元となります.タンパク質の結晶化を行う際に溶液の体積をいろいろと変えると,体積が増加した分以上に結晶の個数が顕著に増加する現象がよく観察されます.浮力(自然)対流は体積の増加に比例して起こりやすくなりますので,このような結晶個数の増加は対流による二次核形成の結果であると考えられます.
また,その一方,非常にgentleな流れであれば,タンパク質の場合においても結晶化に良い効果がもたらされる,とする考えもあります(大阪大学,佐々木孝友先生の研究室).適切な攪拌が行われないと,過飽和溶液中で形成されるクラスターや微結晶などが
容器底部に沈降して来て雑晶発生の原因となる,と説明されています.
いずれにしても,どの程度の流れであれば,タンパク質の結晶化にどのような影響を及ぼすか,についての定量的な実験はまだほとんど行われておらず,今後の研究が待たれます.
 (対流の影響ページのトップへ)
(対流の影響ページのトップへ)
◎追記:浮力対流を無視できる環境を作り出す方法
1)結晶化を行う空間の上下方向の高さを小さくする方法と,2)ゲルを利用する方法の二つが考えられます.
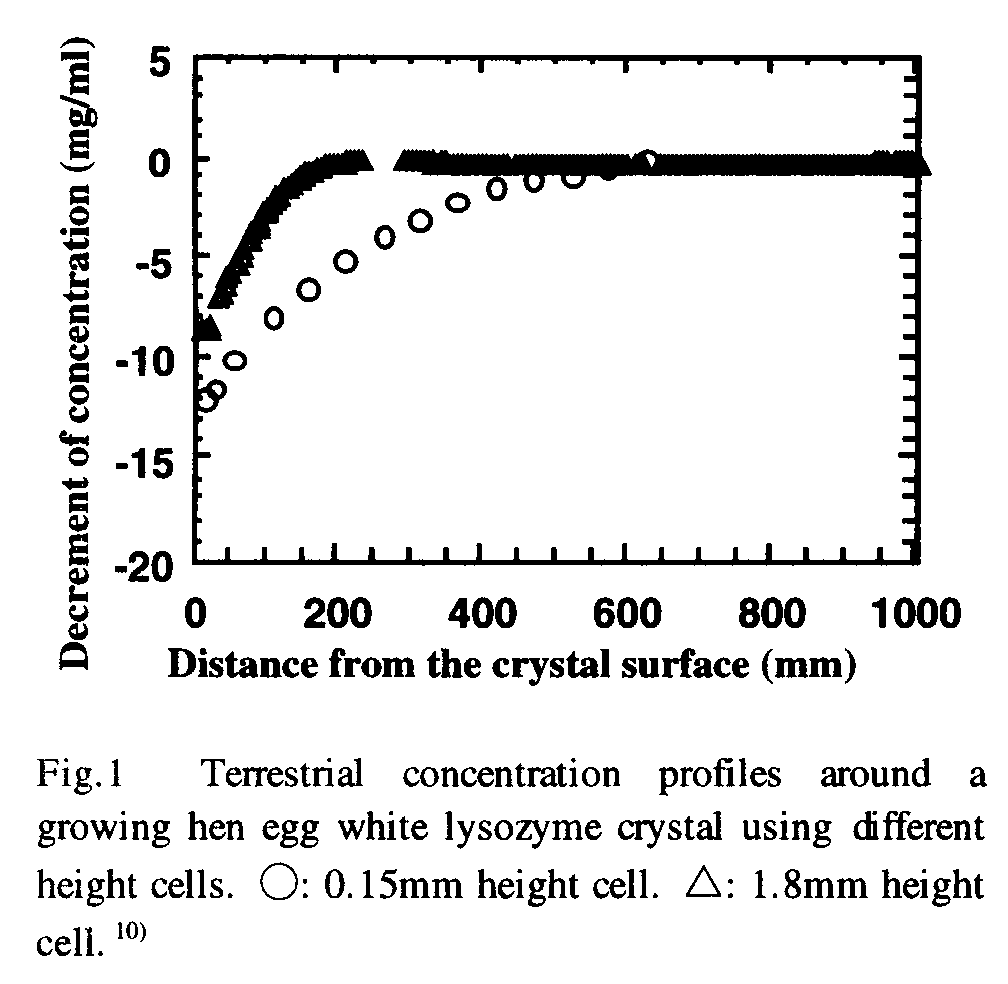 |
| セルの厚みを0.15mmにする事で,結晶周囲の濃度分布は微小重力下での分布とほぼ同じになる.セルの厚みが1.8mmの際には対流の攪拌効果によって,濃度境界層が薄くなり,結晶表面での濃度が上昇していることがわかる.(S.
Miyashita, et al., J. Jpn. Soc. Microgravity Appl., 15 (1998) 577) |
1)上下方向の高さを小さくする方法
密度対流は,重力が働く「高さ方向の溶液の長さの3乗に比例」して発生し安くなります.そこで,溶液層の厚みを薄くして行けばよいことになります.そのような環境は,例えば2枚のスライドガラスの間に適当なスペーサーを挟み込む(OHPシートが最適)ことで作れます.「水」が溶媒の場合には,溶液層の厚みがおよそ150
micron m以下程度であれば,密度対流をほぼ完全に止めることができることが実験でわかっています(右図).しかしながら,そのような非常に薄い溶液相中で十分な大きさのタンパク質結晶を育成することができるか,また,たとえ育成できてもそれがうまくセル外に取り出せるか,は考えなくてはならない問題ですね.
2)ゲルを利用する方法
ゲルの利用については,これまでに多くの報告がなされています.ゲル中では溶液は自由に流動できませんので,そのような状態では対流が発生し得ないことは自明です.
しかしながら,ゲル自体がタンパク質結晶の成長に全く影響を及ぼさないかというと,そうは言い切れないようです.これまでの報告の中では,「シリカゲル」が最も結晶化に及ぼす影響が少なく(ゲル・ネットワークが化学結合で形成されるため,再度の溶液化は不可),ついで「アガロースゲル」(加熱により再度の溶液化は可能)が良いようです.
◎追記:ハンギング・ドロップ法とシッティング・ドロップ法の大きな違いについて
両者は,蒸気拡散法においてどちらも良く用いられる方法です.通常は,シッティングドロップ法の方が多くの試料溶液を仕込むことができるため,試料溶液の量が少ないときにはハンギングドロップ法,結晶を大きくするために大量の溶液を仕込みたいときにはシッティングドロップ法が用いられます.確かにそれは正しいのですが,両者の違いは,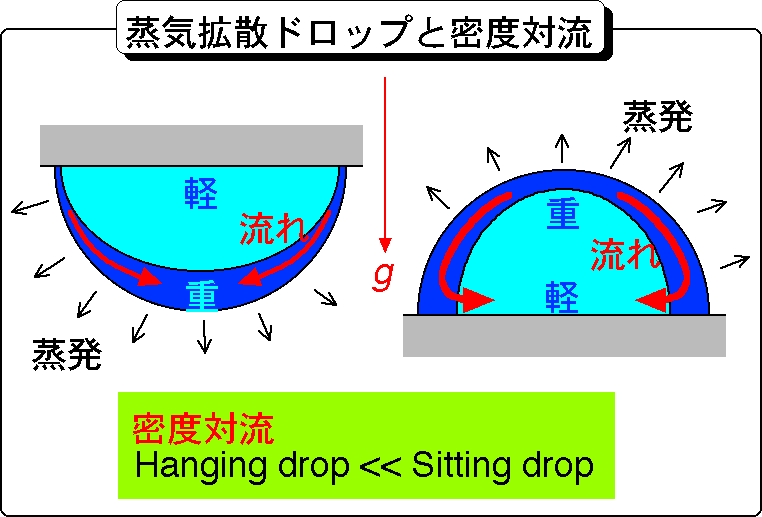 実はそれだけではないのです.
実はそれだけではないのです.
両方のドロップ中の対流の様子を詳細にその場観察してみますと,hanging dropにくらべてsitting
drop中では,桁違いに大きな浮力対流が起こっていることがわかります.メカニズムは次の通りです.蒸気拡散法の場合,ドロップ中の蒸気の気相への拡散に伴い,ドロップ表面付近の溶液中のタンパク質濃度および沈殿剤濃度が高くなります.すなわちドロップの表面付近が内部に比べてより重くなります.これが全ての元です.
1) sitting dropの場合
この場合,ドロップが床に張り付いていますので,ドロップの上部に表面部分の重い溶液が集中します.その結果,重くなった溶液は下に沈み込み,軽い溶液が上部にあがろうとして,活発な浮力対流が発生します.
2)hanging dropの場合
この場合,ドロップが天井に張り付いていますので,ドロップの下部に表面部分の重い溶液が集中します.重い溶液は初めから下部にありますのでそのまま安定に動かずにいます.そのため,浮力対流はあまり発生しません.観察してみると,1)と2)の差は大変顕著で,対流の流速がおよそ1桁違ってきます.
ですので, 対流が激しく起こるsitting dropの方が,hanging dropよりも結晶の成長速度は速くなり,結晶を速く成長させたい場合や,大きな結晶を得たい場合(中性子回折のような)には,sitting
dropの方が有効です.しかし,結晶の品質が良くなるかどうかは上記の「対流の悪影響」の部分で述べましたように,hanging dropの方が有利だと考えられます.
(対流の影響ページのトップへ)
To
the top page; トップページへ,
To the top page of protein crystal
growth; タンパク質結晶成長のトップページへ
 結晶の表面は,
結晶の表面は,
 タンパク質試料を結晶化させている溶液中には,
フィルターなどをかけてきれいにしているつもりでも,実際には非常に多数のゴミや微結晶などのダスト粒子が存在します.微小重力環境下では,溶液中に流れがないためにこれらのダスト粒子はじっとしていますが,対流の存在する系ではこれらの粒子は溶液中を活発に動き回り,結晶上へも頻繁に降ってきます.右図は,そのようなダスト粒子が,結晶状に付着した後,結晶中に取り込まれて行く様子をAFMで観察した様子です.この様なダスト粒子の取り込みが,結晶の品質に良い効果をもたらすはずがありません.
タンパク質試料を結晶化させている溶液中には,
フィルターなどをかけてきれいにしているつもりでも,実際には非常に多数のゴミや微結晶などのダスト粒子が存在します.微小重力環境下では,溶液中に流れがないためにこれらのダスト粒子はじっとしていますが,対流の存在する系ではこれらの粒子は溶液中を活発に動き回り,結晶上へも頻繁に降ってきます.右図は,そのようなダスト粒子が,結晶状に付着した後,結晶中に取り込まれて行く様子をAFMで観察した様子です.この様なダスト粒子の取り込みが,結晶の品質に良い効果をもたらすはずがありません.

 実はそれだけではないのです.
実はそれだけではないのです.