Basic
strategies to grow a protein single crystal of good quality;
良質なタンパク質結晶を得るための基本戦略
何ができるか?
●どういった溶液条件にすると適切な結晶構造を持つ核が晶出するか?
→ 相互作用エネルギーが不明のため,残念ながらまだ手がつきません.
●いったん抄出した結晶の良質化
→ Yes! これには結晶成長学は十分お役に立てる状況にあります.
→ それでは,どうすればよいのか,私なりの私見を独断で下記にまとめました.
【高品質化のための基本戦略】
1)試料タンパク質の高純度精製,2) 効率的な結晶化条件の探索,
3)溶解度曲線の作製,4)溶解度データに基づいた能動的な結晶育成
5)適切な結晶化方法の選択
(タンパク質結晶成長のトップページへ)
それでは,一つづつ
1)試料タンパク質の高純度精製
構造解析屋の方は,「何だ,そんなこと当たり前だよ」とおっしゃるでしょう.そのとおりです.ただ,リゾチームを例にお話ししますと,市販の純度99%の標品(生化学工業製,6回再結晶)をクロマトグラフィーでさらに99.9%まで精製すると,99%標品の結晶化では不純物が結晶の成長を大きく悪さをしていることがありありとわかります(下図)*.構造解析屋の方は,「何,99%でもだめだって? そんなの不可能だ!!」とおっしゃるでしょう.私もそう思います.ただ,不純物にも「種類」があります.結晶化に対して特に悪影響を及ぼす不純物タンパク質は,「目的タンパク質とほぼ同じ構造をしていながら(結晶中によく取り込まれる),それ以降の周期的な分子間結合を妨げる」ようなものです.すなわち,ダイマーやトリマーなどの「オリゴマー」や,「目的タンパク質の一部が変性したもの」が結晶化に最も悪影響を及ぼす不純物として挙げられます.ですので,この様な不純物タンパク質に特に注意する必要があります.
* B.R. Thomas, et al., Acta Cryst. D52 (1996) 776; T. Nakada, et al., J. Cryst.
Growth 196 (1999) 503.
 |
 |
|
市販6回再結晶リゾチーム(〜99%)
つぶつぶに見えるものが,リゾチーム分子同士が共有結合で結ばれてしまってできたダイマー(不純物)です.
|
精製リゾチーム(99.9%)
平滑なファセット面上に二次元島が成長している様子が分かります.
|
|
リゾチーム正方晶系結晶の(101)面のAFM像:
T. Nakada, et al., J. Cryst. Growth 196 (1999) 503
|
(基本戦略ページのトップへ)
2)効率的な結晶化条件の探索
どの様な緩衝液,pH,塩析剤を選べばよいか? ここは,まだ結晶成長屋の関与できていない領域です.市販のスクリーニング・キットなどを利用して,効率的かつ網羅的に探索するしかありません.また,後述の5)でも述べますが,その際の結晶化手法としては,「蒸気拡散法」が最も適した手法といえます.
冒頭に「相互作用エネルギーが不明のために手が着かない」ともうしましたが,まったく戦略がない,というわけではありません.相互作用エネルギーを計算で求めることはまだまだ難しくても,実測することはできます.測定手法としては,動的・静的光散乱法*や浸透圧法**などが簡便な方法として挙げられます.もし,皆さんの研究室にダイナプロ社製のProtein
Solution(動的光散乱光度計)などがあるのであれば,何も単分散性のみを測定するのではなく(それも大切ですが),相互作用にも注目してみてください.タンパク質分子間に「引力」が働いている場合には,拡散係数は小さく,粒径は大きく測定されます.また,逆に「斥力」が働いている場合には,拡散係数は大きく,粒径は小さくなります.まず,初めにタンパク質分子間に「斥力」が働く状況を作り出してやる必要があります(言い換えると,未飽和な状況です).その後,注意深く塩析剤などを加え,分子間に「極わずかに引力」が働く状況を作り出してやる操作が,適切な操作といえます.今後,これら相互作用の取り方と,得られる結晶の品質との相関を明らかにするための研究が重要になると私は思います.
* M. Muschol and F. Rosenberger, J. Chem. Phys. 103 (1995) 10424; W. Eberstein,
et al., J. Cryst. Growth 143 (1994) 71.
** D.F. Rosenbaum and C.F. Zukoski, J. Cryst. Growth 169 (1996) 752.
(基本戦略ページのトップへ)
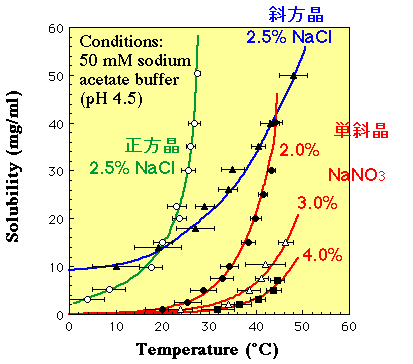
3)溶解度曲線の作製
 |
|
鶏卵白リゾチームの種々の結晶の溶解度曲線
|
さて, 上記の結晶化条件の探索で,ともかく何か結晶らしきものが晶出する条件がだいたい求まれば,後はようやく結晶成長屋の出番です.以前のページで述べたように,結晶化の駆動力(化学ポテンシャルの差)が変わると結晶の成長メカニズムも変わります.そこで,最も結晶の品質が良いと考えられる「渦巻き成長」する過飽和度で結晶を育成すればよいことになります.そのためには,タンパク質結晶の「溶解度」の測定が必須です.
「溶解度測定,そんなモノに費やす貴重な試料と時間はない」と,構造解析屋さんはおっしゃるでしょう.確かに,以前はそのとおりの状況でした.タンパク質分子は低分子化合物と比べて拡散定数が1〜2桁小さく,そして結晶の成長速度も非常に遅いため(数nm/sec以下),過飽和溶液から結晶が成長してやがて溶液濃度が溶解度(平衡濃度)に達するまでに数ヶ月を要してしまいます(低分子化合物の場合には通常数日で十分です).また,溶液濃度を経時的にモニターするには大量の試料を必要とします.そのため,タンパク質の溶解度測定は「時間と試料を浪費するモノ」と考えられてきました.
しかしながら,近年,光干渉法を使った方法*,シンチレーション法**,マイクロカラム法***など,微小容量の溶液量・短時間で測定可能な手法がいくつか開発されてきました.ここでは,我々が開発した光干渉法を用いた手法を紹介します.
* G. Sazaki, et al., J. Crystal Growth, 169 (1996) 355; G. Sazaki, et al., J.
Cryst. Growth 196 (1999) 204; K. Ninomiya, et al., J. Cryst. Growth 222 (2001)
311.
** F. Rosenberger, et al., J. Cryst. Growth 129 (1993) 1.
*** M.L. Pusey and K. Gernert, J. Cryst. Growth 88 (1988) 419; E. Cacioppo,
et al., J. Cryst. Growth 110 (1991) 66; M.L. Pusey and S. Munson, J. Cryst.
Growth 113 (1991) 385.
溶解度測定の原理は,次の通りです.結晶が成長すると周りの溶液中から溶質を取り込むため,結晶の近傍では沖合いの溶液中に比べてタンパク質濃度が低下します.その結果,結晶近傍では屈折率が低下し,光学距離が短くなり,干渉縞が曲がることになります(下左図).結晶と溶液が平衡の時には結晶近傍の濃度分布は均一ですので,干渉縞はまっすぐ平衡に見えます(下中図).また,結晶が溶解する時には,結晶近傍でタンパク質濃度が上昇するために,成長の場合とは逆の方向に干渉縞は曲がります(左右図).すなわち,干渉縞を使って結晶周囲の濃度分布をその場観察することにより,結晶が成長・溶解しているのか平衡状態にあるのかが,一目で判別できます.そのため,タンパク質濃度が既知の溶液を用いると,結晶との平衡温度を1時間以内に決定できます.これまで数ヶ月を要して得ていた溶解度に関する情報が,1時間以内に得ることができるわけです.また,溶解度測定以外にも,結晶化の途中段階での結晶がまだ成長しているかどうかの確認や,結晶が溶けないbufferの調製など,光学顕微鏡で結晶の大きさを測定するよりもずっと敏感に見ることができます.
どういったbufferであれば
 |
 |
 |
|
成長(20℃)
|
平衡(23℃)
|
溶解(30℃)
|
|
リゾチーム正方晶系結晶近傍の干渉縞(G. Sazaki, et al., J. Crystal Growth,
169 (1996) 355)
|
また,結晶の表面上に干渉縞を調整しても,結晶面の厚み方向の移動に伴う干渉縞の動きから,結晶が成長・溶解しているかについて同じ情報を得ることができます*.
* R.J. Gray, et al., J. Crystal Growth, 232 (2001) 10.
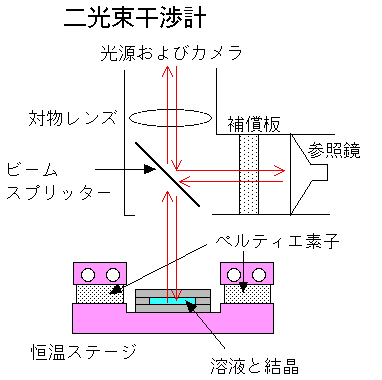
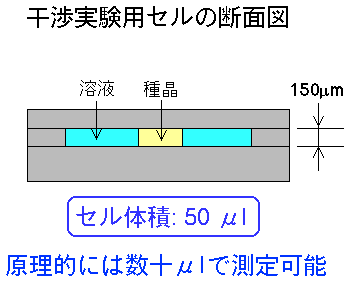
測定に使用する装置は,下図のようになっています.マイケルソン型の二光束干渉計ユニットを反射型の正立顕微鏡に取り付けてあります.光学顕微鏡さえお持ちであれば,15〜25万円くらいで実験できる安価な手法です.観察用セルはスライドガラスもしくは石英ガラスを使って作ってあり,内容量は約50μlです.原理的には数十μlで測定できます.タンパク質濃度数十mg/mlの溶液が数十μl,すなわち約1mgの試料タンパク質があれば,溶解度測定を行うことができます.むしろ,以下に微小容量の試料溶液をハンドリングするか,が現在の問題点です.衣料マイクロデバイス用のマイクロポンプなどが現在盛んに開発されていますが,この様な技術と組み合わせることにより,測定に要する試料容量はさらに少なくすることができると考えています.
 |
 |
|
(G. Sazaki, et al., J. Crystal Growth, 169 (1996) 355)
|
(基本戦略ページのトップへ)
4)溶解度データに基づいた能動的な結晶育成
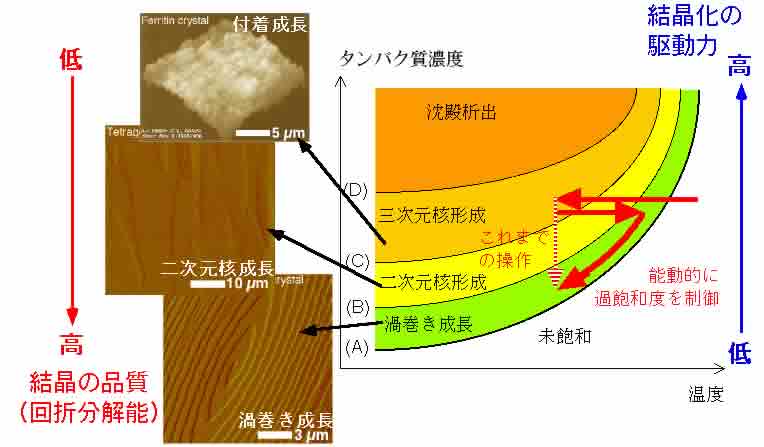
さて,溶解度曲線が3)の様にして選られたならば,溶解度データに基づき,能動的な結晶化操作ができることになります. 例えば,温度を操作パラメータとした場合の一例を下図に示します(溶解度の温度依存性が大きなタンパク質結晶の場合に有利となります).もちろん,操作パラメータを温度だけではなく,タンパク質濃度,沈殿剤濃度,pHなどあらゆるパラメータが利用可能です.図中の(A)のカーブは,上節3)で測定した溶解度曲線です.そして過飽和度が増加すると共に,渦巻き成長→二次元核成長→付着成長と成長メカニズムが変わって行く領域が異なる色で表されています.
 |
|
能動的な結晶化操作の一例:温度を操作パラメータとした場合
|
これまでの結晶化操作の多くは,図中に示されているとおり,何らかの方法で(例えば温度を下げることにより)過飽和溶液を調製した後は,そのまま核形成が起こり結晶が成長するに任せる,という受動的なものでした.そのため,結晶は,あまり品質が良くない成長メカニズムであると考えられる付着成長や,二次元核成長様式で成長せざるを得ませんでした.しかし,溶解度曲線さへわかっていれば,例えば,過飽和溶液調整後,微結晶の晶出を確認するやいなや,高品質な結晶をもたらす渦巻き成長の領域へ結晶化条件をシフトすればよいことになります(図では温度を上げる).この様にして結晶の成長メカニズムをきちんと制御することによってどのくらい結晶の品質が向上するのか,について定量的な測定を行っているところです.また,結果が出ればご報告させていただきます.ただ,結晶を仕込む際の過飽和度を変化させるだけで結晶の品質が明らかに変わることを,NASDAの吉崎さんらが明らかにされています.*
* I. Yoshizaki, et al., J. Crystal Growth, in press; 吉崎 泉,平成13年,東京工業大学総合理工学研究科博士論文.
(基本戦略ページのトップへ)
5)適切な結晶化方法の選択
タンパク質を結晶化させるための手法としては,様々なものがあります.その中で,代表的なものとして,蒸気拡散法,バッチ法,液液拡散法,透析法の4つを取りあげ,下図にその特徴をまとめてみました.縦軸はタンパク質濃度,横軸は沈殿剤濃度です.図中(A)のカーブが溶解度曲線にあたります.タンパク質濃度および沈殿剤濃度が増加するほど,渦巻き成長→二次元核成長→付着成長と結晶の成長メカニズム変化して行く様子は,4)で述べたとおりです.さて,図中の青い矢印は,各結晶化手法を用いた際に,タンパク質および沈殿剤の濃度がどの様に変化して行くかを示しています.
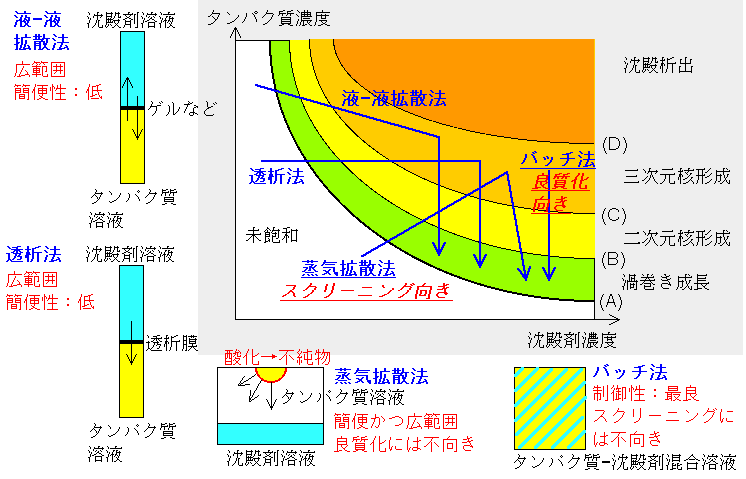
(1)蒸気拡散法:最も多く用いられている手法です.本手法の場合には,上記の拡散と共に溶液が濃縮され,タンパク質濃度と沈殿剤濃度の両方が上昇して行くことが特徴です.やがて,三次元核形成が起こり,結晶が成長し始めますが,その後も時間の経過と共に濃縮され続けます.そのため,上図でおわかりいただけるとおり,結晶化条件はかなり大きな領域を移り変わって行くことになります.幅広い結晶化条件をトレースするため,その中のどこかの条件で結晶が晶出する事が期待されます.上記の2)効率的な結晶化条件の探索でスクリーニングに適した手法であると述べたのは,その理由によります.ただし,タンパク質水溶液は空気相と接触するため,その表面では常に酸化反応が進行します.蒸気拡散法を自分でやられた方は良くおわかりの通り,途中からタンパク質水溶液の表面に「膜」がはった状態に良くなります.これは,酸化によって変性したタンパク質からなる膜です.そのため,せっかく試料タンパク質資料を高度に精製しても,結晶化の最中にどんどん不純物が生成して行くのではその甲斐がありません.また,タンパク質濃度と沈殿剤濃度の両方が時間と共に変化するため,過飽和度も複雑に変化し,4)で述べたように過飽和度を能動的に制御することが大変困難です.そのため,蒸気拡散法は,結晶化条件をラフに決定するためには有効でも,良質な結晶を得るためには不向きな手法であるといえます.それでも,とおっしゃる方には,せめて空気相を窒素などで置換する,などの配慮が必要と考えられます.
(2)バッチ法:最も用いられない方法かもしれません.本手法の場合には,タンパク質溶液と沈殿剤溶液を混ぜ合わせた後,そのまま密封状態で静置するため,時間と共に結晶化条件がたどるプロファイルは最も単純で,結晶の成長と共にタンパク質濃度が減少するだけです.そのため,結晶化のためのラフな条件をスクリーニングするには,ずいぶんと効率が悪い手法であるといえます.しかしながら,空気相が存在しないために,試料タンパク質の酸化が防げるのみならず,結晶化条件の経時変化を予測することが最も簡単なため,4)で述べたような過飽和度の能動的な制御には最も適した手法であります.結晶化条件もおおよそつかめたが,結晶の品質が悪く回折分解能が悪い様な場合には,是非ともバッチ法を用いて,そして過飽和度を能動的に制御して結晶化されることを強くおすすめします.
(3)(4)液液拡散法,透析法:これら二つの手法の特徴としては,蒸気拡散法とバッチ法の両方の利点を併せ持つことが上げられます.すなわち,上図の通り,結晶化条件がたどる経時プロファイルは上記拡散法と同様に幅広くスクリーニングに適しています.また,結晶化条件の経時変化は拡散係数などの物性値がわかっていれば計算によって予測できるため,結晶の良質化のための能動的な操作も可能です.ただ,欠点としては,試料のセットアップがかなり面倒くさく,時間とある程度の慣れが必要なことが上げられます.
以上をまとめると,「初めに蒸気拡散法を用いて効率良くラフなだいたいの結晶化条件をスクリーニングし,いったん結晶が得られた後は,バッチ法を用いて溶解度に基づき過飽和度を能動的に制御する事によって結晶の良質化を目指す」というのが一般的な回答であると考えられます.
(基本戦略ページのトップへ)
To the top page; トップページへ,
To the top page of protein crystal
growth; タンパク質結晶成長のトップページへ









