In-situ observation of elementary growth steps by laser confocal microscopy combined with differential interference contrast microscopy (LCM-DIM);
レーザー共焦点微分干渉顕微法を用いた単位成長ステップのその場観察
本ページではレーザー共焦点微分干渉顕微鏡(LCM-DIM)を用いると,タンパク質結晶表面の単位成長ステップを,完全に非接触・非破壊にその場観察できることを紹介させていただきます(G. Sazaki, et al., J. Crystal Growth, 262, 536-542 (2004)).本顕微鏡は,タンパク質結晶に限らず,透明な物体表面上のnmオーダーの凹凸に十分なコントラストを与え,検出することができます.これから様々な分野で応用していただければと思います.本装置を使った共同研究など大歓迎ですので,ご興味を持たれた方はどうぞご連絡くださいませ.
1)その場観察法に望まれる特質(原子間力顕微鏡と比較して),2)LCM-DIM法の原理について,
3)タンパク質結晶表面の「単位成長ステップ」が観察できることの証明,4)微分干渉コントラストの重要性 ,
5)タンパク質結晶表面の「その場観察例(ムービー)」,6)これから応用が期待される研究対象(タンパク質結晶に関して)
1)その場観察法に望まれる特質(原子間力顕微鏡と比較して)
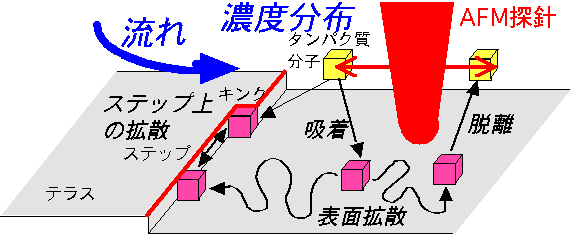 他のページで紹介しましたように,近年,原子間力顕微鏡 (AFM) の発達により,タンパク質結晶の表面モルフォロジーを分子レベルでその場観察できるようになってきました.これにより,タンパク質結晶の場合にも,成長の基本メカニズムは無機結晶のものと変わらないことが明らかにされてきました(S.D. Durbin, et al., J. Crystal Growth, 122 (1992) 71; S.D. Durbin, et a., J. Phys. D 26 (1993) B128).しかし, AFM の場合にはカンチレバーで結晶表面をスキャンすることが必須でありますため,大きな欠点もあります.右図に,タンパク質結晶が成長する素過程の模式図を示しました.AFMの欠点としては次の3点が挙げられます.
他のページで紹介しましたように,近年,原子間力顕微鏡 (AFM) の発達により,タンパク質結晶の表面モルフォロジーを分子レベルでその場観察できるようになってきました.これにより,タンパク質結晶の場合にも,成長の基本メカニズムは無機結晶のものと変わらないことが明らかにされてきました(S.D. Durbin, et al., J. Crystal Growth, 122 (1992) 71; S.D. Durbin, et a., J. Phys. D 26 (1993) B128).しかし, AFM の場合にはカンチレバーで結晶表面をスキャンすることが必須でありますため,大きな欠点もあります.右図に,タンパク質結晶が成長する素過程の模式図を示しました.AFMの欠点としては次の3点が挙げられます.
1)タンパク質結晶は大変柔らかいため,カンチレバーの走査による「ダメージ」を完全に取り除くことは難しい.
2)カンチレバーの走査は,結晶表面近傍の「タンパク質濃度分布」や「流れ」にも大きな擾乱をもたらす.
3)
観察セル中の温度や蒸発の制御も困難である.
1)の欠点は,観察操作の熟練やタッピング(ノンコンタクト)モードの利用である程度軽減することはできますが,完全になくすことは原理上出来ません.また,結晶表面上の溶質濃度の分布や流れは,単位ステップの成長に大きな影響を及ぼし,ステップのバンチング(束化)やインクルージョンの取り込みに大きな影響を及ぼします.そのため,2)に挙げたように,結晶表面近傍の「タンパク質濃度」や「流れ」を大きく擾乱してしまうようでは,結晶の成長過程をあるがままに正しく評価しているとは言えません.さらに,3)系の温度のわずかな変動や試料溶液の蒸発は,結晶化駆動力に変動を与えてしまいます.そのため,タンパク質結晶の成長素過程を真に理解するためには,完全に非接触・非破壊な顕微法で成長過程をその場観察する必要があります.
光学顕微鏡は,系に完全に非接触・非破壊であるのみならず,温度や蒸発などの制御も容易であるため,タンパク質結晶の成長過程をその場観察する手法として大変有望であります.光学顕微鏡の横方向の分解能は使用する光の波長の制限を受けますため,サブミクロン程度にとどまります.しかしながら,「試料高さ方向のコントラストは波長の制限を受けませんため, 1nm 以下の段差等を十分に可視化できます 」(S. Amelinckx, Nature 167 (1951) 939) .そのため光学顕微鏡は,原理を理解してきちんと用いると,高さ方向にはまさに AFM に匹敵する分解能を持ちます.
(レーザー共焦点部分干渉顕微法ページのトップへ)
2)LCM-DIM法の原理について
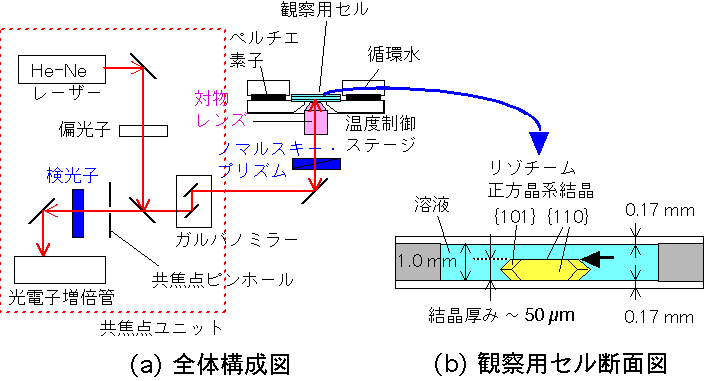 ガルバノミラーで走査するタイプの共焦点顕微鏡は, 1988 年に実用第1号機が世に出た比較的新しい顕微鏡です (T. Takamatsu, S. Fujita, J. Microsc. 149 (1988) 167.) .共焦点顕微鏡はピンホールを用いて対物レンズの焦点面以外からの情報を除去することで,像を格段に向上させます.しかし,従来の方式ではニポウディスクを用いるために,照明の光量が低下するのが欠点でした.走査型レーザー共焦点顕微鏡では,ガルバノミラーを用いてレーザー光を走査し,光電子増倍管で受光することで,この欠点を克服しています.
ガルバノミラーで走査するタイプの共焦点顕微鏡は, 1988 年に実用第1号機が世に出た比較的新しい顕微鏡です (T. Takamatsu, S. Fujita, J. Microsc. 149 (1988) 167.) .共焦点顕微鏡はピンホールを用いて対物レンズの焦点面以外からの情報を除去することで,像を格段に向上させます.しかし,従来の方式ではニポウディスクを用いるために,照明の光量が低下するのが欠点でした.走査型レーザー共焦点顕微鏡では,ガルバノミラーを用いてレーザー光を走査し,光電子増倍管で受光することで,この欠点を克服しています.
オリンパス光学の斎藤良治氏は,レーザー共焦点顕微鏡に微分干渉機能を付加することで,透明な物体表面のnmオーダーの凹凸にコントラストを与えることができるのではないかと発想しました.その発想を元に既存のレーザー共焦点顕微鏡に改造を加え,透明な物体の表面観察にどこまで迫ることができるか,我々と共同で実験を行ってきました.右図に,レーザー共焦点微分干渉顕微鏡の模式図を示します.微分干渉コントラストを得るためにノマルスキープリズムを用いるのはもちろんですが,偏光子(ポーラライザー)と検光子(アナライザー)を適切な方向を向けて入れることがミソです.また,2枚のカバーガラスを用いて観察用セルは作られており,結晶と溶液の自由界面での成長を観察しています.各種光学顕微法については,下記の本を参考にしてください.
参考文献:野島 博 (1997) 顕微鏡の使い方ノート ,羊土社;藤田晢也 (1996) 新しい光学顕微鏡 1, 2 巻,学際出版;宝谷紘一,木下一彦 (1991) 限界を超える生物顕微鏡:見えないものを見る ,学会出版センター.
(レーザー共焦点部分干渉顕微法ページのトップへ)
3)タンパク質結晶表面の「単位成長ステップ」が観察できることの証明
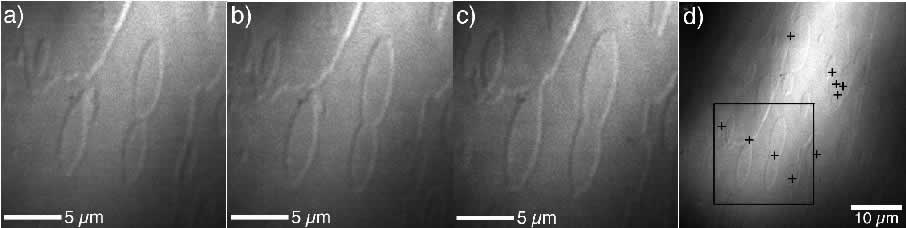
走査型レーザー共焦点顕微鏡に微分干渉機能を付加した顕微鏡(LCM-DIM)で,リゾチーム正方晶系結晶{110}表面をその場観察した一例を下図に示します.図a-c は,結晶表面上の2次元アイランドが,成長に伴い合体してゆく様子を示します.隣り合うアイランドの合体に伴い,アイランドのステップ(縁)のコントラストが完全に消滅することがおわかりいただけることと思います.このことは,2つのアイランドの「高さ」が等しいことを示しています.下図d 中の四角は,図a-c で示した領域に相当します.また,図中の+印は,アイランドの合体に伴うステップ・コントラストの消滅が観察された部位を示しています.図d に示したように,結晶表面上の至る所でステップのコントラストが消滅することより,観察されているステップは全て高さが等しい,すなわち「単位成長ステップ」であることが証明できます.走査型レーザー共焦点微分干渉顕微鏡を用いることで,タンパク質結晶表面の単位成長ステップ(下図の場合 5.6nm 高さ)を十分なコントラストでその場観察できることを右図は示しています.光学顕微鏡でも,高さ方向には AFM に十分匹敵するその場観察が,非接触・非破壊でできることがおわかりいただけたことと思います.画像1枚の取得に要する時間が約 10 秒程度と, AFM (数分)に比べて格段に短いため,高速でその場観察できることも本顕微鏡の大きな利点です.
(レーザー共焦点部分干渉顕微法ページのトップへ)
4)微分干渉コントラストの重要性
 共焦点顕微鏡の利点は,結晶中のインクルージョン(結晶化溶液が取り込まれた空洞)からの散乱光や結晶底面からの反射光など,焦点面以外からの情報を除外できる点にもあります.通常の反射型顕微鏡の場合には,観察面以外からの反射光を除去するために,観察する結晶面に対して結晶底面や観察セル底面を傾ける必要があります.また,通常の透過型顕微鏡の場合には,結晶内部からの散乱光を除去するために,インクルージョンなどのない高品質な結晶が必要となります.このような角度調整や高品質結晶を必要とせず,高いコントラストで表面観察できる点に共焦点顕微鏡の特徴があります.
共焦点顕微鏡の利点は,結晶中のインクルージョン(結晶化溶液が取り込まれた空洞)からの散乱光や結晶底面からの反射光など,焦点面以外からの情報を除外できる点にもあります.通常の反射型顕微鏡の場合には,観察面以外からの反射光を除去するために,観察する結晶面に対して結晶底面や観察セル底面を傾ける必要があります.また,通常の透過型顕微鏡の場合には,結晶内部からの散乱光を除去するために,インクルージョンなどのない高品質な結晶が必要となります.このような角度調整や高品質結晶を必要とせず,高いコントラストで表面観察できる点に共焦点顕微鏡の特徴があります.
また,単位成長ステップを十分なコントラストで観察するには,微分干渉機能も大きな寄与を及ぼしています. このことをご理解頂くために,右図に微分干渉機能を入れないで撮影したリゾチーム正方晶系結晶{110}表面(a),および微分干渉機能を入れて撮影した同じ視野(c)を示します.微分干渉コントラストを用いない通常のレーザー共焦点顕微鏡の場合には(図a),ステップのコントラストは大変小さい.それに対し,微分干渉機能を加えると十分なステップのコントラストを得ることができます(図c).どちらの写真も,画像処理を全く加えていないオリジナルのものです.また,単位ステップに十分なコントラストを与えるためには,対物レンズの開口数(N.A.: Numerical Aparture)は関係ないことがわかりました.もちろん,あまりに低倍率すぎて(N.A.が小さすぎて)アイランド分解視できないようではだめですが, それよりもレンズの偏光特性の方が重要になります(低倍率レンズの方が偏光特性は良いですから).
(レーザー共焦点部分干渉顕微法ページのトップへ)
5)タンパク質結晶表面の「その場観察例(ムービー)」
LCM-DIMを用いてその場観察した,リゾチーム正方晶系結晶が成長する様子の一例をムービーでごらんいただきたいと思います.左図は結晶が低過飽和度下でうずまき成長(spiral growth)する様子を,そして右図は高過飽和度下で2次元核成長(birth and spread type)する様子です.観察しているステップは,全て5.6nm高さの単位ステップです.ミクロンオーダーのマクロな表面観察では,AFMに匹敵する情報が得られることがおわかりいただけると思います.
(レーザー共焦点部分干渉顕微法ページのトップへ)
6)これから応用が期待される研究対象(タンパク質結晶に関して)
 右図にリゾチーム結晶表面上のらせん成長丘をその場観察した一例を示します.らせん成長丘の中心付近ではステップは単位高さ( 5.6nm )ですが,周辺部にむかうにつれてステップ同士がバンチング(束化)してステップの高さが高くなるため,ステップはより大きなコントラストを示します.このようなステップ・バンチングの主原因は結晶表面近傍の浮力対流ですが,「流れ」が個々の成長ステップの挙動に及ぼす効果については,これまで十分な観察手段がなかったためにあまり研究が行われてきませんでした.レーザー共焦点微分干渉顕微鏡を用いると,様々な「流れ」の下で個々の単位成長ステップのその場観察が可能になりますため,タンパク質結晶の成長や品質に及ぼす「微小重力効果」について,研究が進展すると期待しています.
右図にリゾチーム結晶表面上のらせん成長丘をその場観察した一例を示します.らせん成長丘の中心付近ではステップは単位高さ( 5.6nm )ですが,周辺部にむかうにつれてステップ同士がバンチング(束化)してステップの高さが高くなるため,ステップはより大きなコントラストを示します.このようなステップ・バンチングの主原因は結晶表面近傍の浮力対流ですが,「流れ」が個々の成長ステップの挙動に及ぼす効果については,これまで十分な観察手段がなかったためにあまり研究が行われてきませんでした.レーザー共焦点微分干渉顕微鏡を用いると,様々な「流れ」の下で個々の単位成長ステップのその場観察が可能になりますため,タンパク質結晶の成長や品質に及ぼす「微小重力効果」について,研究が進展すると期待しています.
右図に示したらせん成長丘の中心部分では,単位成長ステップのコントラストは2次元アイランド(3)の挿入図)のものに比べてずっと小さくなっています.これはらせんステップの間隔が2次元アイランドのステップ間隔に比べてずっと小さいことによります.光学顕微鏡の横方向の分解能は波長の制限を受けますため(数100nm程度),間隔の小さなステップ同士を分解視することは困難になります.やはりこの点では,レーザー共焦点微分干渉顕微鏡と AFM は相補的であります.
(レーザー共焦点部分干渉顕微法ページのトップへ)
To the top page of in-situ observation of protein crystallization; タンパク質結晶化過程のその場観察のトップページへ
To the top page; トップページへ,
 他のページで紹介しましたように,近年,原子間力顕微鏡 (AFM) の発達により,タンパク質結晶の表面モルフォロジーを分子レベルでその場観察できるようになってきました.これにより,タンパク質結晶の場合にも,成長の基本メカニズムは無機結晶のものと変わらないことが明らかにされてきました(S.D. Durbin, et al., J. Crystal Growth, 122 (1992) 71; S.D. Durbin, et a., J. Phys. D 26 (1993) B128).しかし, AFM の場合にはカンチレバーで結晶表面をスキャンすることが必須でありますため,大きな欠点もあります.右図に,タンパク質結晶が成長する素過程の模式図を示しました.AFMの欠点としては次の3点が挙げられます.
他のページで紹介しましたように,近年,原子間力顕微鏡 (AFM) の発達により,タンパク質結晶の表面モルフォロジーを分子レベルでその場観察できるようになってきました.これにより,タンパク質結晶の場合にも,成長の基本メカニズムは無機結晶のものと変わらないことが明らかにされてきました(S.D. Durbin, et al., J. Crystal Growth, 122 (1992) 71; S.D. Durbin, et a., J. Phys. D 26 (1993) B128).しかし, AFM の場合にはカンチレバーで結晶表面をスキャンすることが必須でありますため,大きな欠点もあります.右図に,タンパク質結晶が成長する素過程の模式図を示しました.AFMの欠点としては次の3点が挙げられます. ガルバノミラーで走査するタイプの共焦点顕微鏡は, 1988 年に実用第1号機が世に出た比較的新しい顕微鏡です (T. Takamatsu, S. Fujita, J. Microsc. 149 (1988) 167.) .共焦点顕微鏡はピンホールを用いて対物レンズの焦点面以外からの情報を除去することで,像を格段に向上させます.しかし,従来の方式ではニポウディスクを用いるために,照明の光量が低下するのが欠点でした.走査型レーザー共焦点顕微鏡では,ガルバノミラーを用いてレーザー光を走査し,光電子増倍管で受光することで,この欠点を克服しています.
ガルバノミラーで走査するタイプの共焦点顕微鏡は, 1988 年に実用第1号機が世に出た比較的新しい顕微鏡です (T. Takamatsu, S. Fujita, J. Microsc. 149 (1988) 167.) .共焦点顕微鏡はピンホールを用いて対物レンズの焦点面以外からの情報を除去することで,像を格段に向上させます.しかし,従来の方式ではニポウディスクを用いるために,照明の光量が低下するのが欠点でした.走査型レーザー共焦点顕微鏡では,ガルバノミラーを用いてレーザー光を走査し,光電子増倍管で受光することで,この欠点を克服しています.
 共焦点顕微鏡の利点は,結晶中のインクルージョン(結晶化溶液が取り込まれた空洞)からの散乱光や結晶底面からの反射光など,焦点面以外からの情報を除外できる点にもあります.通常の反射型顕微鏡の場合には,観察面以外からの反射光を除去するために,観察する結晶面に対して結晶底面や観察セル底面を傾ける必要があります.また,通常の透過型顕微鏡の場合には,結晶内部からの散乱光を除去するために,インクルージョンなどのない高品質な結晶が必要となります.このような角度調整や高品質結晶を必要とせず,高いコントラストで表面観察できる点に共焦点顕微鏡の特徴があります.
共焦点顕微鏡の利点は,結晶中のインクルージョン(結晶化溶液が取り込まれた空洞)からの散乱光や結晶底面からの反射光など,焦点面以外からの情報を除外できる点にもあります.通常の反射型顕微鏡の場合には,観察面以外からの反射光を除去するために,観察する結晶面に対して結晶底面や観察セル底面を傾ける必要があります.また,通常の透過型顕微鏡の場合には,結晶内部からの散乱光を除去するために,インクルージョンなどのない高品質な結晶が必要となります.このような角度調整や高品質結晶を必要とせず,高いコントラストで表面観察できる点に共焦点顕微鏡の特徴があります.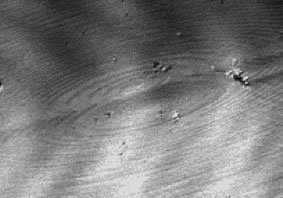

 右図にリゾチーム結晶表面上のらせん成長丘をその場観察した一例を示します.らせん成長丘の中心付近ではステップは単位高さ( 5.6nm )ですが,周辺部にむかうにつれてステップ同士がバンチング(束化)してステップの高さが高くなるため,ステップはより大きなコントラストを示します.このようなステップ・バンチングの主原因は結晶表面近傍の浮力対流ですが,「流れ」が個々の成長ステップの挙動に及ぼす効果については,これまで十分な観察手段がなかったためにあまり研究が行われてきませんでした.レーザー共焦点微分干渉顕微鏡を用いると,様々な「流れ」の下で個々の単位成長ステップのその場観察が可能になりますため,タンパク質結晶の成長や品質に及ぼす「微小重力効果」について,研究が進展すると期待しています.
右図にリゾチーム結晶表面上のらせん成長丘をその場観察した一例を示します.らせん成長丘の中心付近ではステップは単位高さ( 5.6nm )ですが,周辺部にむかうにつれてステップ同士がバンチング(束化)してステップの高さが高くなるため,ステップはより大きなコントラストを示します.このようなステップ・バンチングの主原因は結晶表面近傍の浮力対流ですが,「流れ」が個々の成長ステップの挙動に及ぼす効果については,これまで十分な観察手段がなかったためにあまり研究が行われてきませんでした.レーザー共焦点微分干渉顕微鏡を用いると,様々な「流れ」の下で個々の単位成長ステップのその場観察が可能になりますため,タンパク質結晶の成長や品質に及ぼす「微小重力効果」について,研究が進展すると期待しています.