トップページ (2電子原子も含む正確な新ボーア模型)
電子スピンは実在しない
我々の新しいボーア模型によって、ヘリウム原子の基底状態エネルギーの計算で、量子力学的な変分法よりも正確な結果をだすのに成功した。(トップページ参照のこと)。
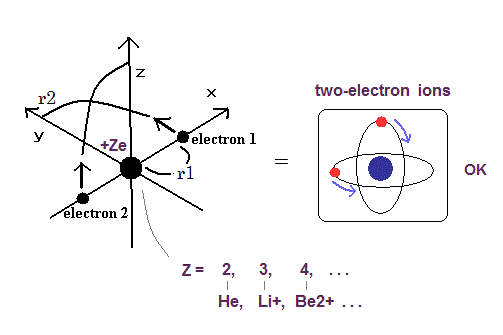
この成功した新ボーア模型では、ヘリウム原子 (He) の2つの電子は、ちょうど1ド・ブロイ波長の互いに垂直な軌道上を運動している。
また、この新しい原子模型は、パウリの排他原理の現象も正確に説明できる。なぜなら、この新しいボーアの2電子原子には、3つめの電子が入りこむスペースがないからだ。
驚くべきことに、この新しいボーアのヘリウム構造は、他の2電子原子(イオン)である、リチウムイオン (Li+)、ベリリウムイオン (Be2+)、ホウ素イオン (B3+)、炭素イオン (C4+) にも正確にあてはめることができた。
(このページを参照のこと。)
さらに、3電子原子である、リチウム原子 (Li) のイオン化(基底状態の)エネルギーも、近似的なボーア模型の”2S”軌道を使用して、計算することができた。(このページも参照のこと。)
それでは、我々は、この新しい原子模型を他の2電子原子(イオン)にもあてはめることができるだろうか?
Fig. 1. 2電子原子模型 ( He, Li+, Be2+, B3+, C4+ .. O6+... )

ここで、酸素原子のイオン化エネルギーを示す。
| Name | 1st | 2nd | 3rd | 4th | 5th | 6th | 7th | 8th |
|---|---|---|---|---|---|---|---|---|
| 酸素 (O) | 13.618 | 35.117 | 54.935 | 77.413 | 113.899 | 138.119 | 739.290 | 871.410 |
Table 1に示すように、1S 電子のイオン化エネルギー (赤い 数値) は、他のイオン化エネルギーに比べてかなり大きい。
このことは、酸素原子においても、2つの "1S" 電子のみが他の電子よりも原子核にかなり近いことを示す。
酸素イオン ( O6+ ) のイオン化エネルギーは、739.290 + 871.410 = 1610.70 eV である。
(上の Table 1 を参照のこと。つまり、全(基底状態の)エネルギーの実験値は、-1610.70 eV である。)
我々は、O6+ の2つの電子軌道が Fig.1 のようになっていると仮定する。
詳細な計算方法は、トップページか、ボーアのリチウムのページを参照のこと。
ここでは、次のサンプルJAVAプログラムを使う。
(このプログラムでは、便宜のため次のような新しい単位を使う。 1 MM = 10-14 meter, 1 SS = 10-22 second, 1 MM/SS = 108 m/s.)
Table 2 は、O6+ が様々なエネルギ−準位のときの、last VY (電子1が 1/4 周した後の速度の y 成分)がゼロになるときの r1 と WN ( 1/4 周の軌道に含まれるド・ブロイ波の数 )を示す。
( last VY がゼロのとき、電子は、安定した軌道上を運動することができる。)
| E (eV) | r1 (MM) | WN | WN x 4 |
|---|---|---|---|
| -1600.0 | 692.0 | 0.25124 | 1.00496 |
| -1605.0 | 690.0 | 0.25087 | 1.00348 |
| -1610.0 | 688.0 | 0.25045 | 1.00180 |
| -1616.0 | 685.5 | 0.25000 | 1.00000 |
| -1620.0 | 683.5 | 0.24970 | 0.99880 |
| -1625.0 | 681.5 | 0.24932 | 0.99728 |
| -1630.0 | 679.5 | 0.24894 | 0.99576 |
つまり、O6+ の全エネルギーが、-1616.0 eV のとき、1軌道に含まれるド・ブロイ波の数はちょうど 1.00000 となる。
上で言ったように、O6+ のエネルギーの実験値は、-1610.70 eV である。
誤差は、たった、5.3 eV である。O6+ のイオン化エネルギーはとても大きいため、誤差はたった、0.33% である。
つまり、酸素イオン (O6+) においても、2電子の軌道面は互いにほとんど垂直になるということができる。
酸素原子の3番目の電子が、2 (1でなく) ド・ブロイ波長の軌道に入ることを確認するために、
ここでは、、3電子原子である、酸素イオン (O5+) に挑戦することにする。
酸素イオン (O5+) は、1S軌道に2つの電子と、2S軌道に1つの電子をもっている。
1Sの2つの電子は、8e+ の原子核に強くひきつけられているため、2S の電子に比べてかなり原子核に距離的に近いところにある。
つまり、近似的に、我々は2S電子が、 +6e 原子核 (+8e - 2e = +4e) の周りの2ド・ブロイ波長の円軌道を回っているとみなすことができる。
(これは、我々が2S電子において、近似的に水素原子の式を使えることを意味する。)
ボーア模型によれば、n × ド・ブロイ波長の軌道の半径 (Rb) は、次のように なる。
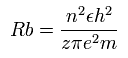
( z = 1 と n = 1 のとき、 Rb はいわゆる”ボーア半径”となる。)
O5+ の 2S 電子では、原子核の陽電荷 z は、6+ と近似的にみなすことができ(上を参照)、また、n は 2 である。
計算すると、この Rb は 4/6 × ボーア半径 ( = 0.3527 × 10-10 meter ( = 3527 MM ) となる。
(ここでは、便宜のため次のような新しい単位を使う。 1 MM = 10-14 meter, 1 SS = 10-22 second, 1 MM/SS = 108 m/s.)
水素様原子のエネルギー準位は、
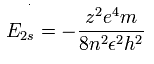
O5+ の 2S 電子では、n=2 と z=6 をこの式に代入する。
そのため、炭素イオン (O5+) の原子模型をつぎのように仮定できる。
Fig. 2. 酸素イオン (O5+) 模型
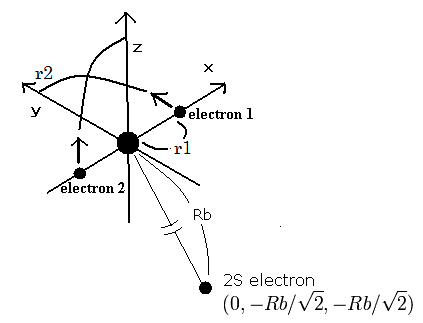
1Sの2つの電子はなるべく2S電子を避けるように運動する。そこで、我々は2S電子を Fig. 2. に示すように ( 0, - Rb / √2, - Rb / √2 ) に固定する。
(Fig.2 は3つの電子の相対的な位置関係を示している。実際は、この2Sの電子は1Sの電子よりもゆっくりと核の周りを周回している。)
O6+ のように (このページも参照のこと)、電子1が、(x, y, 0) にあるとき、電子2は、 (-x, 0, y) にある。
つまり、各粒子間の距離は、
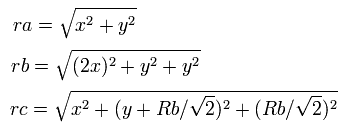
となる、ここで、ra は電子1と核の距離、rb は2つの 1S 電子間の距離、rc は電子1と 2S の電子の距離である。
電子1の加速度 (m/sec2) の x成分は、
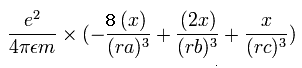
となる。
同様に、電子1の加速度 (m/sec2) の y成分は、
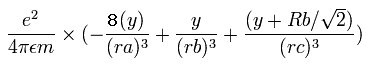
となる。
また、O6+ のときのように、1S 軌道の 1/4 周に含まれるド・ブロイ波の数を計算する。
サンプルJAVAプログラム (O5+)
Table 3 は、O5+ において、 last VY (電子1が 1/4 周した後の速度の y 成分)がゼロに一番近い時の結果を示す。
| E (eV) | r1 (MM) | WN | WN x 4 |
|---|---|---|---|
| -1730.0 | 694.5 | 0.25124 | 1.00496 |
| -1735.0 | 692.5 | 0.25083 | 1.00332 |
| -1740.0 | 690.0 | 0.25046 | 1.00184 |
| -1746.0 | 688.0 | 0.25000 | 1.00000 |
| -1750.0 | 686.0 | 0.24967 | 0.99868 |
| -1755.0 | 684.0 | 0.24930 | 0.99720 |
| -1760.0 | 681.5 | 0.24892 | 0.99568 |
この結果は、O5+ イオンの基底状態エネルギーが -1746.0 eV のとき、軌道の長さがド・ブロイ波長の ちょうど 1.00000 倍になることを示している。
酸素イオン (O5+) の基底状態のエネルギーの実験値は、 -138.119 -739.290 -871.410 = -1748.8 eVである。
つまり、計算誤差は、わずか 2.8 eV ( 0.16 % ) である。
(この小さな計算誤差は、おそらく、”近似的な”2S電子軌道を用いたことによると考えられる。)
このことは、酸素イオン (O5+) の3つの電子が、 Fig. 2 に示すように運動していると言ってほぼ間違いないということを意味する。
(つまり、酸素原子の3番目の電子は、2 (1でなく) ド・ブロイ波長の軌道に入る。)
中性の酸素 (O) においては、6つの 外殻 軌道の電子(価電子) はどう動いているのだろうか?
酸素は、8つの電子をもっており、そのうち、2つの 1S 軌道の電子は 原子核にとても近づいている。 (上の O5+ のセクションを参照のこと。)
つまり、近似的に、6つの外殻電子が +6e の中心核 (+8e-2e = +6e) の周りを周回していると仮定することができる。
また、6つの 価電子は、互いに避け合って、かつ対称的に核の周りを動いていると思われる。
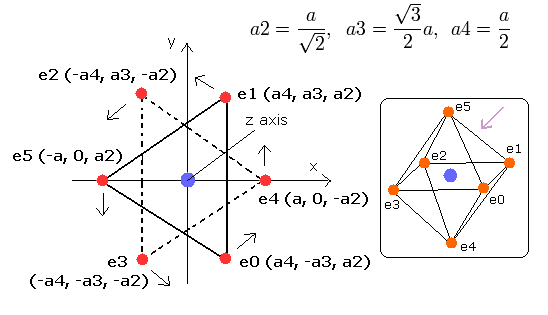
正多面体の中で、正八面体 が、6つの頂点 ( = 6つの価電子 ) をもっており、最初に酸素の6つの外殻電子が正八面体のように配置されていると仮定する。
(ここでは、6つの価電子の全エネルギーを -433.103 eV = 1 から 6 のイオン化エネルギーの合計と仮定する。)
そこで我々は、酸素原子の6つの価電子が、Fig.3-1 に示すように正八面体状に配置されていると仮定できる。
Fig. 3-1. 推定される酸素原子 (正八面体). 原子核=(0,0,0)
ここでは、次のサンプル JAVA プログラム (version 1.5 (5.0)) を使って画面上に酸素原子の電子の運動を視覚化してみることにする。
このプログラムは少し長いので、中に示すソースプログラムをコピーして、テキストエディタ(メモ帳など)にそのまま貼り付けて、コンパイルすれば簡単に実行できる。
このプログラムの class file name は oxygen2 なので、このデキストエディタを "oxygen2.java" のファイル名で保存してコンパイルしてほしい。
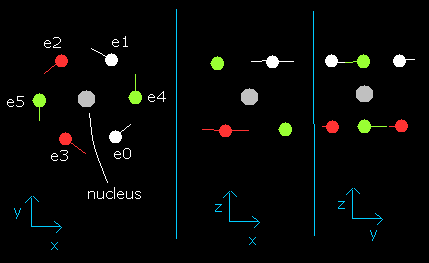
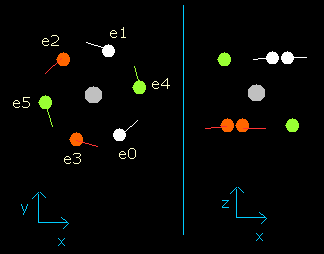
このプログラムでは、酸素原子核は、灰色の円 (Fig. 3-2 参照)で表示している。
また6つの電子は、e0, e1 は白、e2, e3 は赤、e4, e5 は緑色の円でそれぞれ示してある。
x, y, z 軸は Fig.3-1 に示す軸と同じである。
左、真ん中、右の図はそれぞれ、x-y, x-z, y-z 平面を表している。
また、各電子の速度ベクトルは線で示してある。
Fig. 3-2. プログラム中の酸素原子核と6つの価電子 (wn=0)
テキストボックス内の電子の各座標 (+X (MM), +Y (MM), +Z (MM)) は、この原子核からの”相対的な”位置座標を示している。
ここでは次のような新しい単位を用いている。
"nuc (MM)" は、核と各電子の間の距離を意味している。
"VX: VY: VZ" は電子の初速度の各成分の比を示している。
つまり、(VX: VY; VZ)=(100:100;0) は、(VX: VY: VZ) = (10:10:0) と同じ意味である。
スクロールバー (0.1 -- 2.0) の中から、ド・ブロイ波の数 (=wn) を選んで、"orbit" ボタンをクリックすると、このプログラムは、軌道に含まれるド・ブロイ波の数が wn になるまで電子軌道計算を続ける。
詳細な計算方法については、トップページを参照のこと。
微小時間 (1 SS) ごとに、6つの電子と核の間のクーロン力を計算し、その結果を基に各速度ベクトルを変化させていく。
また、各電子につき、微小区間に含まれるド・ブロイ波の数も計算していく。
(このプログラムでは、6つの価電子の全エネルギーは、第1〜6のイオン化エネルギーの合計である、-433.103 eV としている。)
このプログラムは、テキストボックスと模式図としての両方に、各電子の最後の座標と速度ベクトルの結果を表示する。
それから、"retur" ボタンをクリックすると、すべての電子は、また最初のスタートラインの状態に戻ることができる。
また、"radiu" ボタンの隣のテキストボックスに a (MM) (Fig.1参照) の値を入力して "radiu" ボタンをクリックすれば、Fig.3-1 に示すように、6つの電子の正八面体の大きさ(半径)が変化する。
最初に、a (MM) として、3820 の値を入力して "radiu" ボタンをクリックしてみる。
(この場合は、Fig.3-1 の a の値は 3820 (MM) となり、原子核と各電子の最初の距離 (=nuc) は 4678 MM となる。)
次に、スクロールバーの中から、ド・ブロイ波の数 (wn) として 0.5 を選んで、"orbit" ボタンをクリックしてみると、計算が開始して、次のようなイメージ結果が表示される。
Fig. 3-3. wn = 0.5 における酸素原子の電子
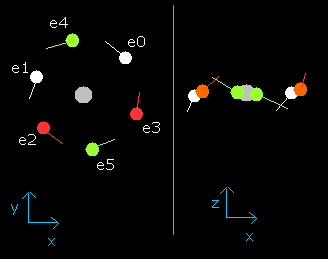
電子が、0.5 ド・ブロイ波長分の軌道を進んだとき (wn=0.5)、酸素の6つの価電子はすべて、x-y 平面近くに位置している (Fig. 3-3 右図)。
また、この地点 (wn=0.5) では、原子核と電子の距離は約 4204 MM である。
次に、"retur" ボタンをクリックして、wn=0 の最初の状態に戻ろう。
それから、スクロールバーの中で 0.9 の値をド・ブロイ波の数 (wn) として選び、また"orbit" ボタンをクリックする。(Fig.3-4)
Fig. 3-4. wn = 0.9 における酸素原子の電子
このイメージ結果は、電子が 0.9 ド・ブロイ波長分の軌道を進んだとき、酸素原子の6つすべての価電子は、その最初の位置から正反対のところに移動していることを示している。
wn=0.9 の地点では、原子核と電子の間の距離は最も短く ( = 3801 MM) なる。
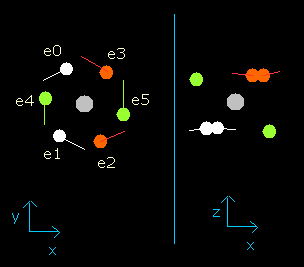
また、"retur" ボタンを押して、今度は 1.9 の値を選択し、"orbit" ボタンをクリックしてみる。
結果は、Fig.3-5 に示すようになる。
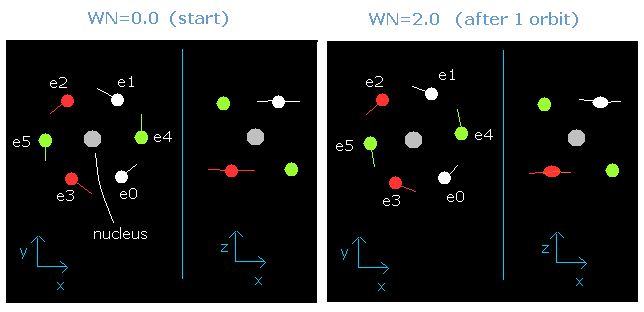
Fig. 3-5. wn = 1.9 における酸素原子の電子 (=ほぼ wn=0.0 と同じ。)
この結果は、6つすべての電子が、1.9 (ほぼ 2.0) ド・ブロイ波長分の軌道を進んだときに元の位置に戻ることを証明している。
(おそらく、これらの軌道は少しだけ歳差運動や揺れ運動をしていると思われる。)
上のプログラムでは、中心の仮の正電荷をちょうど +6.0e ( = +8e (原子核) -2e (2つの 1S 電子) = +6e) としている。
しかし、上のセクションで示したように、2つの 1S 電子は、約 700 MM ほど、+8e の酸素原子核から離れている。(それらは、核にくっついているわけではない。)
そのため、6つの外殻電子に影響を与える"実質的な中心電荷"は、おそらく +6.0e よりも少し大きくなるだろう。
そこで、ここでは、中心の仮の正電荷を +6.0e のかわりに +6.3e として、もう一度軌道計算をしてみることにする。
サンプル JAVA プログラム (中心の仮電荷 +6.3e )
このサンプルプログラムは、中心の仮の正電荷を除いて上に述べたプログラムと同じである。
このプログラムでは、電子の進んだ軌道の長さが ちょうど 2.0 ド・ブロイ波長分になったとき、酸素の6つの価電子すべてが 次に示すように、もとの位置に戻ることができる。
Fig. 3-6. wn = 0.0 と wn = 2.0 のときの酸素の価電子 (”実質的な”中心電荷 = +6.3e)
この結果はとても重要である。
6つの価電子の全エネルギーがある値 (=-433.103 eV) に決定すると、1軌道の平均の長さはだいたい一意的に決まる。
(このことは、全エネルギーの値を決めると、平均の軌道長、すなわち1軌道に含まれるド・ブロイ波の数が”自動的に”決まることを意味している。)
そして、この波の数が、中性の酸素原子の場合は 2.0 になることが証明された。
(つまり、この結果は、酸素原子の6つの価電子は、 2.0 ド・ブロイ波長の軌道上を運動していることを示している。)
上の O5+ の場合は 中心電荷を +6.0 としてほぼ正確な結果をだせた。これは、Fig.2 のスタート地点においては、この近似によって生じる誤差はわずかだからである。
このページ (ボーア模型における 1S 電子と 2S 電子の関係) も参照のこと。
中心の正電荷 (Z) がちょうど +6.0e (=+8e-2e) としたとき、1軌道に含まれるド・ブロイ波の数 (wn) は、 1.9 になる。
しかし、実際は2つの 1S 電子は +8e の原子核にくっついていないので、この中心電荷 (Z) を +6.3e (+6e より少し大きく) と仮定すると、上に示したように、1軌道のド・ブロイ波がちょうど 2.0 になった。
ここでは、このことを ビリアル定理 (Virial theorem) を用いて証明してみることにする。
我々は、次に示すように酸素の6つの価電子が +Ze の中心電荷の周囲に”八面体状に”配置されていると仮定する。
Fig. 4. 酸素原子の価電子 ("有効" 中心電荷 = +Ze)
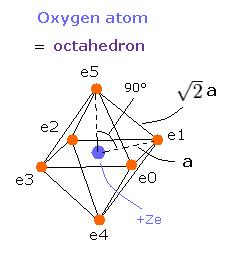
Fig. 4 では、電子と中心の正電荷の距離を a とする。
ビリアル定理によれば、”平均の”全位置エネルギー (V) と運動エネルギー (T) は次の関係にある。
< V > = -2 × < T > , E = V + T
6つの価電子の全エネルギー (E) は、-433.103 eV なので、この位置エネルギー (V) は、2 × -433.103 = -866.206 eV となる。
Fig. 4 の模型を使って、電子ー核、 電子ー電子の間の電位を計算していくと、全位置エネルギー V ( 単位 eV --> J ) は次のように示せる。
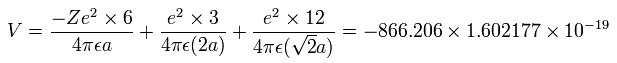
また、6つの電子の全運動エネルギー (T) は、433.103 (eV) である。
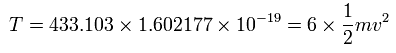
また、Fig.4 より、電子1つにはたらくクーロン力の合計 (F) は(核方向の力になるが)、次のようになる。
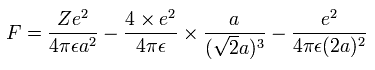
上の式の T 中の速度 (v) と、力 F の値を用いて、遠心力がこの力 (F) に等しいと仮定する。
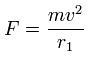
この r1 は、この関係式で初めて登場する 仮の半径である。
この r1 を用いて、次に示すように、1軌道に含まれる ド・ブロイ波の数 (wn) を計算することができる。
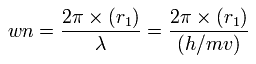
中心電荷 Z が +6.0 のとき、この wn は 1.88 (ほぼ 1.9) となる。
また、Z = +6.3 のとき、この wn は、ちょうど 2.01 になる。
つまり、我々はビリアル定理によって、このことを証明することができた。
O6+ と O5+ のセクションで示されたように、2つの 1S 電子と核の間の距離は、約688 MM である。
つまり、この結果 (最も短くなるときの距離が 3801 MM) は、6つの外殻の電子が内殻の電子にぶつからず、安全に運動できることを示している。
例えば、水分子 (H2O) の O-H 結合長は、9584 MM である。つまり、この計算値 4679 MM はだいたい妥当な値と考えられる。
ところで、酸素原子の6つの価電子は、Fig. 3-1 に示すように本当に正八面体状に配置されているのだろうか ?
炭素原子では、4つの価電子は、正四面体状に配置されていた。( ボーアの炭素のページも参照のこと。)
正四面体においては、中心(核)と頂点(電子)をむすぶ線の間の角度は、ちょうど 109.5 ° になる。
実際に、メタン分子 (CH4) においては、4つの電子は正四面体状に配置されており、H-C-H の角度はちょうど 109.5 ° である。
炭素様原子である。ケイ素 (Si) においても、ケイ素と水素の化合物である、モノシラン (monosilane = SiH4) は正四面体状の構造を有している。(H-Si-H の角度は、109.5°。)
水分子 (H2O) では、2つの水素原子と、酸素の2つの非共有電子対 が、”正四面体”状に配置されていると言われている。
しかし、H-O-H の角度は、104.45°で、これは109.5°よりも少し小さい。
どうして、この角度は、109.5°よりも小さいのだろうか?
また、正八面体においては、中心(核)と、頂点(電子)をむすぶ線の間の角度は、90°になる。
つまり、104.45°は、90°と109.5°の間にある。
もし、酸素原子の構造が正八面体だとしたら、どうして H-O-H の角度は90°にならないのだろうか?
驚くべきことに、他の酸素様原子である、硫黄(S)、セレン(Se)、テルル (Te) においては (これらは、6つの価電子を持つが)、H-S-H, H-Se-H, H-Te-H の角度は、それぞれ 92.1°、91.0°, 89.5° となり、ほぼ90°になるのである。
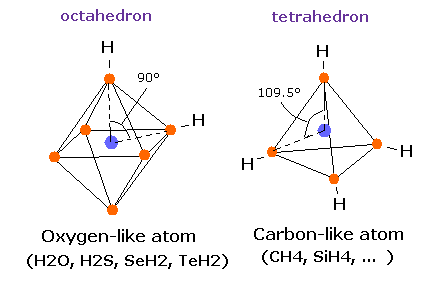
つまり、これらの酸素様原子においては、6つの価電子は、ほぼ”正八面体状に”配置されているということができる。
酸素原子においては、水素原子が、他の酸素様原子よりも、酸素原子により近づいている。
このため、酸素と水素の電子間のクーロン反発力 (もしくは、2つの水素原子核間の反発力)によって、水分子(H2O) は、”正八面体”の構造を保つことができないと考えられる。
(もし、2つの水素原子が、酸素原子のちょうど正反対の位置にあるとすると、電子は、この2つの水素原子核によって正反対の方向にひきつけられる。
そのため、酸素原子核の周囲の電子密度が”不自然に”低くなり、おそらく、こうなる可能性は低いと考えられる。)

2010/8/22 updated This site is link free.