塩の加水分解
|
|
弱酸と弱塩基からなる塩の液性は難しいです。 酢酸アンモニウム水溶液の水素イオン濃度を求めるには、次の4次方程式を解く必要があります。 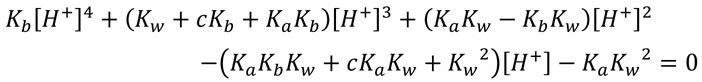 学ぶ項目を、ステップを細かく分けて一覧にしました。 「この項目は大丈夫だな。」と思うものは飛ばしてもらって結構です。 自分に必要な項目だけを学べば良いでしょう。 カッコ内は、文部科学省の学習指導要領に従った、目安となる履修学年です。 【酸と塩基】 (01)電解質(中3)・・・水溶液にすると電気を流す物質です。 (02)非電解質(中3)・・・水溶液にしても電気を流さない物質です。 (03)電離(中3)・・・電解質を水に溶かしたとき、陽イオンと陰イオンに分かれることです。 (04)スバンテ・アレニウス・・・スウェーデンの化学者です。 酸と塩基を次のように決めました。 (05)酸(中3)・・・電離して、水素イオンを生じる物質です。 (06)アルカリ(中3)・・・電離して、水酸化物イオンを生じる物質です。 高校以降「塩基」と呼びます。 (07)問題発生・・・アンモニアは、分子中に -OH を持っていないけれど、塩基性を示します。 (08)ヨハンス・ブレンステッド・・・酸と塩基を再定義したデンマークの化学者です。 (09)トーマス・ローリー・・・酸と塩基を再定義したイギリスの化学者です。 (10)酸(高1)・・・水素イオンを与える物質です。 (11)塩基(高1)・・・水素イオンを受け取る物質です。) 【塩の加水分解】 (12)中和(中3)・・・酸と塩基が反応して、お互いの性質が打ち消されます。 (13)塩(中3)・・・中和により生じる、酸の陰イオンと塩基の陽イオンからなる化合物です。 (14)塩の分類(高1)・・・「正塩(中性塩)」「酸性塩」「塩基性塩」に分けられます。 (15)酸性塩(高1)・・・水素イオンを一部残している塩です。 (16)塩基性塩(高1)・・・水酸化物イオンを一部残している塩です。 (17)正塩(中性塩)(高1)・・・それら以外の塩です。 (18)塩の加水分解(高1)・・・塩が水と反応して、その一部が元の酸や塩基に戻ります。 (19)酢酸ナトリウム水溶液・・・弱酸と強塩基の塩なので、水溶液は塩基性を示します。 (20)塩化アンモニウム水溶液・・・強酸と弱塩基の塩なので、水溶液は酸性を示します。 (21)塩化ナトリウム水溶液・・・強酸と強塩基の塩なので、水溶液は中性を示します。 (22)酢酸アンモニウム水溶液・・・弱酸と弱酸の塩です。 中性? 「酸と塩基」に戻る |
|
|