前のページへ 次のページへ
二酸化炭素(CO2)の水に対する溶解度の温度変化を図15に示します[6]。図15から水温が上昇すると二酸化炭素の溶解度は小さくなることが示されます。
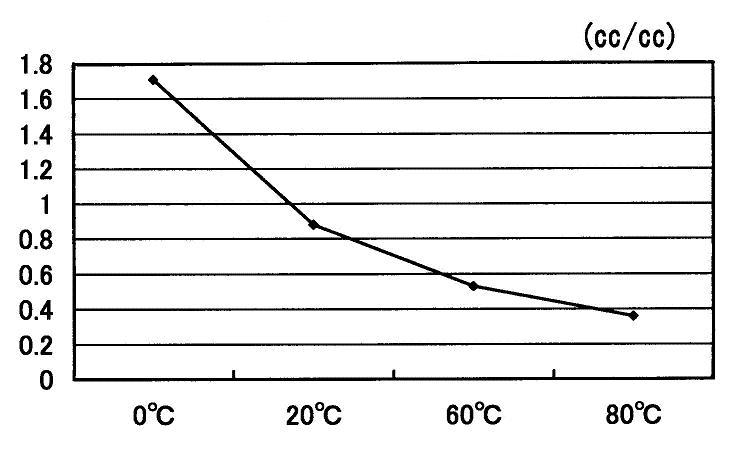
図15 二酸化炭素(CO2)の水に対する溶解度の温度変化
3.1.c 電気陰性度の値
電子の状態は周囲の状況によって変化し、電気陰の値も置かれた状況によって変化しますが、化合物や分子内で原子がどの程度電子を引きつけるかを相対的に数値で表す尺度があって、ポーリングによって経験的に定義された電気陰性度の値を図16に示します。 図16の電気陰性度の値は電子を引きつける力の相対的な関係の目安です。電気陰性度とイオン化傾向の性質によって、炭酸水中で鉄の原子は二酸化炭素の酸素と結合し、残った炭素原子が水素原子ではなくて鉄の原子と結びつくことが理解できます。
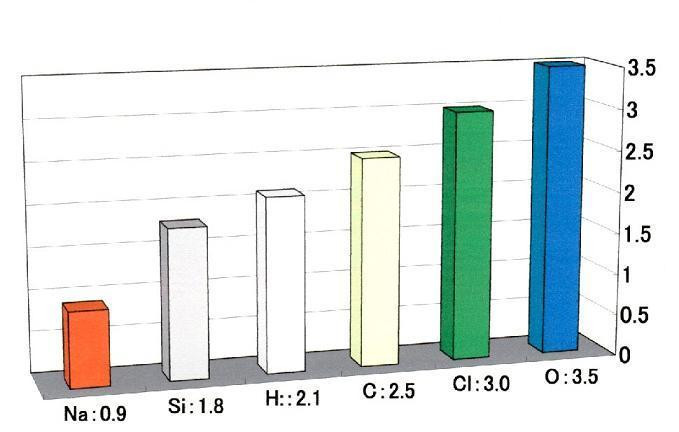
図16 電気陰性度(ポーリングの値)
ここで、電気陰性度の起源をNaClを例にして説明します。イオン結合モデルにおいてはCl のp-電子が詰まり閉殻構造となり、Naのs-電子が空で閉殻構造となります。然るに、Cl の原子が電子を引き寄せる力が大きいのは何故でしょうか。価電子は化合して原子の状態とは異なる軌道にあります。 閉殻の軌道は球形でp-軌道は回転楕円体です。閉殻軌道に囲まれたClのp-軌道はNaの核の引力領域内に侵入し、 p-軌道に囲まれたNaの核の引力領域はp-軌道に侵入されたようになります。 そこで、化合物のNaClの中でClのp-軌道は正電荷の核の引力をより多く受けて、電子を引きよせる力を多く受けるのです。
-3.2- 目次へ