
Fluorescent-labeled lysozyme: correlation between impurity effects and intermolecular bondings inside crystals; 蛍光ラベル化リゾチーム:不純物効果と結晶中での分子間相互作用の相関
本ページでは,分子表面の特定の部位のみを特異的に「蛍光ラベル化」したリゾチーム分子について紹介させていただきます(T. Matsui, et al., J. Crystal Growth, 293 (2006) 415-422).松井さんが学際センターで作製してくれた試料です.ここでは分子間相互作用から見た不純物効果について紹介させていただきますが,本試料はその後の結晶表面上での「表面拡散」や「吸着・脱離過程」の1分子その場観察など,当プロジェクトのその場観察実験の中心的な役割を果たしています.
1)不純物効果の研究に望まれる特質,2)蛍光ラベル化リゾチーム(F-リゾチーム)の調製,3)結晶中の分子間接触と蛍光ラベル化部位の相関,4)核形成に及ぼすF-リゾチームの効果,5)成長に及ぼすF-リゾチームの効果,6)F-リゾチームの実効分配係数,7)その後の展開,について
1)不純物効果の研究に望まれる特質:分子間相互作用の制御について
タンパク質の結晶化に及ぼす不純物効果については,これまでに様々な報告がなされています.そして,目的タンパク質と分子構造が似ている不純物タンパク質ほど分離・除去が難しく,目的タンパク質結晶に容易に取り込まれ,結晶品質を低下させることが知られています.また,そのような不純物タンパク質は,一般に,目的タンパク質結晶の成長速度を低下させ,その結果,結晶のモルフォロジーを変化させることもよく知られています.しかしながら,不純物タンパク質が結晶にどのように取り込まれるのか,またその取り込み量は何で決まるのか,などについての個々の報告例はありますが,不純物タンパク質の性質と結晶との相互作用の相関について,首尾一貫した説明をすることはこれまでできませんでした.
それでは,この点を明らかにするためには,どのような研究がなされなければならないでしょうか.我々は,次のような特性を持つタンパク質を不純物として利用した研究を行うことが必須であると考えています:1)結晶表面で溶質分子が取り込まれる際に「特定の分子間接触(相互作用)」のみの阻害がおこること(そうでなければサイエンスになりません),および2)結晶中に取り込まれた不純物タンパク質を非常に高い感度で検出できること,の2点です.
1)については,目的タンパク質の分子表面の特定のサイト1つのみを人為的に変異させたタンパク質が不純物タンパク質として有望であると考えられます.
2)については,蛍光ラベルしたタンパク質は,0.1μMオーダーの感度で検出できることが以下の研究により実証されています(Y. Iimura, et a., Jpn J. Appl. Phys. 42 (2003) 5831; Y. Iimura, et al, Cryst. Growth Des. 5 (2005) 301-305).このような高い検出感度は,目的タンパク質結晶中での不純物タンパク質の濃度やその分布を研究するために必須であります.
そこで我々は,鶏卵白リゾチームの分子表面の特定のサイトのみを選択的に蛍光ラベル化し,この分子(以下,F-リゾチーム)の不純物効果を,結晶内部での分子間接触が異なるリゾチーム正方晶系結晶および単斜晶系結晶について調べました.その結果,不純物効果には「結晶表面上の特定の分子間接触の阻害」が決定的に重要な役割を果たすことを明らかにしました.このような概念はこれまでにも想像されてきましたが,実験的に直接その証拠を得ることに成功した点が本研究のポイントです.
 |
反応生成物のSDS-PAGEによる分析結果.(a) UV302nmによる蛍光,(b) Coomassie brilliant blue R-250によるリゾチームの染色.リゾチーム溶液中のアミノ基に対して反応させた5-TRITCのモル比:0.1 (lane 1) , 0.5 (lane 2), 1.0 (lane 3), 2.0 (lane 4), 5.0 (lane 5). |
2)蛍光ラベル化リゾチーム(F-リゾチーム)の調製について
蛍光ラベル化するための色素としては,市販の蛍光色素の中で最も蛍光の発光強度が強い色素の一つであるtetramethylrhodamine-5-isothiocyanate (5-TRITC, MW=443 g/mol, Molecular Probes T-1480)を用いました.この試薬は,アミノ基と化学反応して結合する官能基を有しています.リゾチームの分子表面には7つのアミノ基が存在しますため,リゾチームと5-TRITCとの反応条件を様々に変えてやることで,リゾチーム分子表面の最も反応しやすいアミノ酸残基1つのみを5-TRITCで化学修飾することができると考えました.リゾチームと5-TRITCのモル比を様々に変えて反応させ,生成物をSDS-PAGEで分離し,蛍光強度(紫外線302nm)およびCoomassie染色した結果を右図に示します.図より,モル比1.0以上で反応させると複数のアミノ基が蛍光ラベルされてしまうのに対し,モル比0.1および0.5で反応させると1つのアミノ基のみが蛍光ラベルされていることがわかります.そこで,モル比0.5を最適反応条件としました(反応収率57%).
次に,
上記の操作で蛍光ラベル化されたアミノ基が,リゾチームが分子表面に持つ7つのアミノ基のうちどれであるのかを特定するために,次の実験を行いました.まず,蛍光ラベル化リゾチームをリジル・エンド・ペプチダーゼで限定加水分解し,得られたペプチド断片をトリシン-SDS-PAGEで分離し,蛍光ラベル化された断片のみを単離しました.そして,この断片のアミノ酸配列をN末端側からプロテイン・シーケンサーで読むことにより,リゾチームのN末端にあるLys1のε-アミノ基が蛍光ラベル化されていることを明らかにしました.以降,この蛍光ラベル化リゾチームをF-リゾチームと呼びます.
3)結晶中の分子間接触と蛍光ラベル化部位の相関について
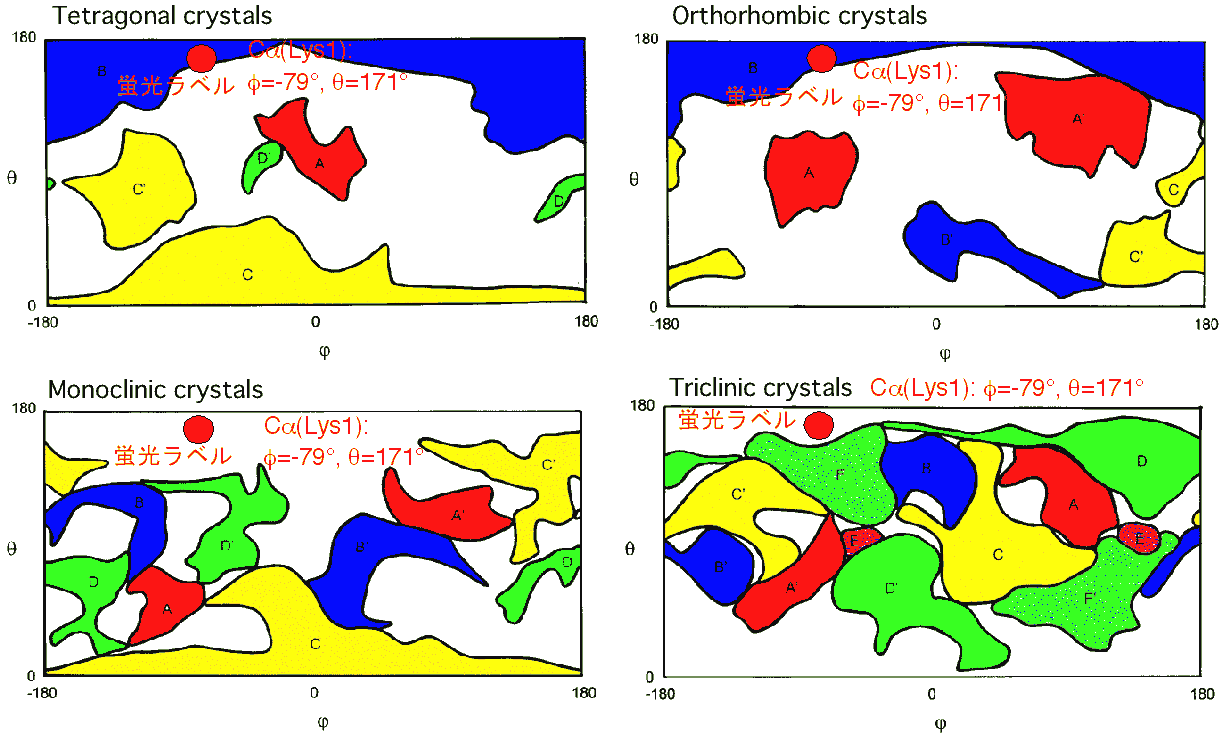
リゾチームのN末端Lys1のεアミノ基のみが蛍光ラベル化されたF-リゾチームが調製できましたので,次に,この蛍光ラベル化部位がリゾチームの各結晶多形中の分子間接触部位に対してどの位置に相当するのかを調べました.下図に,松浦先生によって同定された各晶系中の分子間接触部位(Y. Matsuura, A.A. Chernov, Acta Cryst. D 59 (2003) 1347)と蛍光ラベル化位置の関係を示します.図は,球形のリゾチーム分子の表面を,世界地図で用いられるメルカトール表記で示しています.蛍光ラベル化されているLys1は,図中のφ=-79°, θ=171°に あたります.正方晶および斜方晶では蛍光ラベルは分子間接触部位Bに位置します.そのため,F-リゾチームがいったんこれらの結晶表面に吸着すると,その後の分子間接触を阻害し,大きな不純物効果をもたらすと予想されます.一方,単斜晶および三斜晶では蛍光ラベルは分子間接触部位にはあたりません.そのため,これらの結晶については,正方晶・斜方晶に比べてF-リゾチームのもたらす不純物効果は小さいものと予想されます.そこで次ぎに,リゾチームの正方晶および単斜晶の核形成と成長に及ぼすF-リゾチームの不純物効果について調べました.
4)核形成に及ぼすF-リゾチームの効果
それではまず,リゾチーム正方晶および単斜晶の「核形成」に及ぼすF-リゾチームの不純物効果を下図にまとめます.正方晶の場合には,F-リゾチームによって核形成が顕著に抑制されることがわかります(a2, b2).この核形成の抑制は,データは示しませんが,リゾチーム濃度19.8-51.5 mg/mlの条件では非常に再現性よく起こることを確認しています.一方,単斜晶の場合には,F-リゾチーム濃度0.02-0.04 mg/ml,リゾチーム濃度20.8-40.0 mg/mlの条件下では,F-リゾチームによる核形成の抑制は観察されませんでした(c2, c3, d2, d3).これらの結果は,3)で述べた予想が正しいことを強く支持します.
これまでに報告では,鶏卵白リゾチームの核形成を抑制するためには,七面鳥卵白リゾチームの場合には14 wt%程度の濃度が(V. Bhamidi, et al., J. Crystal Growth 204 (1999) 542),そしてリゾチーム酸化物の場合には3 wt%程度の濃度が(B.R. Thomas, et al., Acta Cryst. D 54 (1998) 226)必要であることが報告されています. それにくらべてF-リゾチームの場合には,a2, b2で示した様に,わずか0.050-0.065%程度の濃度で顕著な核形成抑制効果が見られます.この結果は,正方晶の場合にはF-リゾチームはこれまでに報告されているどの不純物よりも強い不純物効果をもたらすことを示しています.一方,単斜晶の場合には核形成は抑制されませんでした(c2, c3, d2, d3).これらの結果は,分子間接触の阻害が不純物効果において非常に重要な役割を果たすことを直接示す初めての証拠となります.また,目的タンパク質とわずかだけ構造が異なるタンパク質が,最も顕著な不純物効果を示すことがわかります.
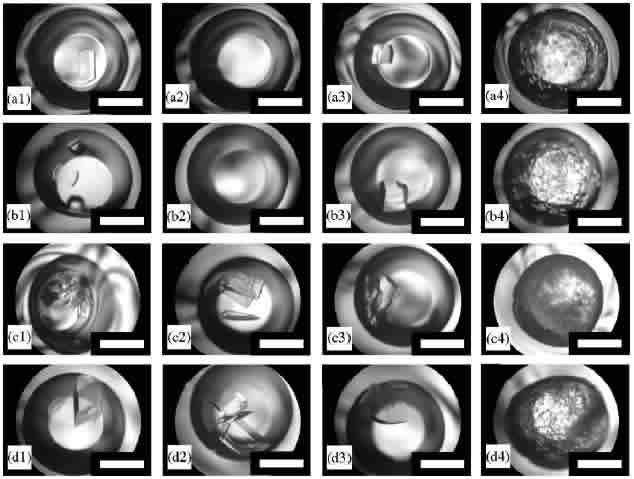
リゾチーム正方晶(aとb)および斜方晶(cとd)の核形成に及ぼすF-リゾチームの不純物効果.リゾチーム書濃度: (a) 30.8, (b) 40.0, (c) 29.8, (d) 40.0 mg/ml.F-リゾチーム濃度:(1) 0, (2) 0.02, (3) 0.04, (4) 0.05 mg/ml.結晶化開始後3日間,22.0℃で静置した.スケールバー:1 mm.
さらに上図ではもう一つの不純物効果が観察されます.F-リゾチーム濃度が0.05 mg/mlと濃い場合には(a4, b4, c4, d4)正方晶・斜方晶ともに核形成が顕著に促進されました.この結果は,高濃度のF-リゾチームは「不均一」核形成を引き起こすことを意味しています.また,低濃度のF-リゾチ−ムは正方晶の「均一」核形成を抑制したことを意味します(a2, b2).F-リゾチームは蛍光色素5-TRITCの為に,リゾチームよりも疎水的で,溶解度も小さくなります(疎水的凝集のため,0.3 mg/ml以上にはF-リゾチームを濃縮することが出来ませんでした).従って,高濃度のF-リゾチームを過飽和溶液に添加すると凝集体が形成され,この凝集体が不均一核として働いたものと考えられます.凝集体は特定の構造を持たないため,結晶多形によらず不均一核として機能しうると考えると,実験結果を説明することが出来ます.逆に,特定の構造を持たないものでも不均一核として働きうることを上記の結果は示していると考えています.
5)成長に及ぼすF-リゾチームの効果
次に,リゾチーム正方晶および単斜晶の「成長」に及ぼすF-リゾチームの不純物効果を調べました.まず,観察セル中で正方晶および単斜晶の種結晶を成長させておき,その後,セル中の溶液を特定の濃度のF-リゾチームを含む過飽和溶液と入れ替えました.そして,種結晶の「面成長速度」を測定しました(これらの実験は,レーザー共焦点微分干渉顕微鏡の開発前に行いましたため,単位ステップの成長速度ではなく,面成長速度を測定しています;論文化に時間がかかりすぎました).正方晶については{110}および{101}面の,そして単斜晶については{101}および(010)面の成長速度を測定しました(単斜晶では,(010)面と(0-10)面は結晶学的に異なります:H. Hondoh, et al., Cryst. Growth Des. 1 (2001) 327).
(1)リゾチーム正方晶系結晶について
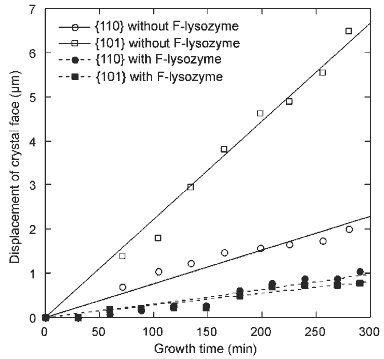
正方晶系結晶での結果を左下図に示します.測定した両結晶面ともに,F-リゾチームによって成長が顕著に阻害されました.面成長速度は,{110}面では57%,そして{101}面では88%も低下しました.これらの結果は,予想通り,F-リゾチームが結晶表面に吸着した後,分子間接触の形成を強く抑制することを示しています.この結果は,正方晶では蛍光ラベルが分子間接触Bの部位に修飾されていることによります.
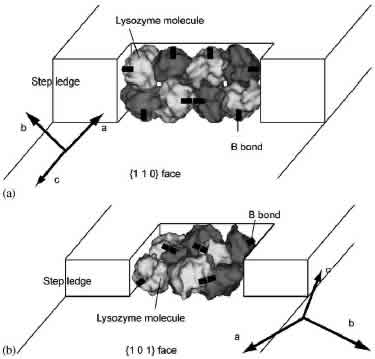
また,F-リゾチームによる成長の阻害が,{110}面に比べて{101}面の方が大きかったことは,成長に及ぼす不純物効果について有用な示唆を与えます.正方晶の{110}および{101}面中の分子間パッキングの模式図を右下に示します.単位成長ステップは,{110}面では2分子高さであり(J.H. Konnert, et al., Acta Cryst. D 50 (1994) 603),{101}面では1分子高さである(T. Nakada, et al., J. Crystal Growth 196 (1999) 503)ことが知られています.図中の太い実線は,F-リゾチームによって阻害されている正方晶中の分子間接触Bの場所と向きを示しています.図より,{110}面では,分子間接触Bは4つが面と水平(面内)で残る4つが面と垂直(面外)であることがわかります.また,{101}面では,8つの分子間接触B全て画面と水平(面内)であることがわかります.この結果より,不純物がステップの成長を阻害する際には,ステップレッジ上(面内)の分子間接触が阻害される方が,テラス上(面外)での阻害に比べて,ステップの前進により大きな阻害効果が現れるものと推測されます.
 |
 |
|---|---|
正方晶の面成長速度に及ぼすF-リゾチームの不純物効果.リゾチーム濃度:22.0 mg/ml,F-リゾチームの濃度:0.02 mg/ml (リゾチームに対して0.09%). |
正方晶の{110}面(a)および{101}面(b)における分子パッキングの模式図.図中の太い実線はF-リゾチームによって阻害されている分子間接触Bを示す. |
(2)リゾチーム単斜晶系結晶について
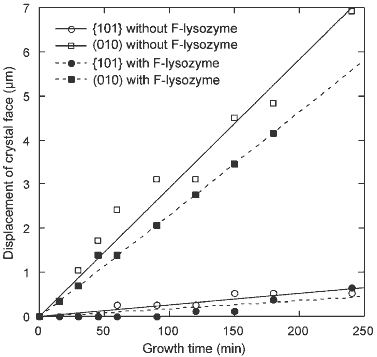
次に,単斜系結晶での結果を同様に左下図に示します.測定した両結晶面ともに,F-リゾチームによる成長の阻害はわずかでした.面成長速度は,{101}面では29%,そして(010)面では20%しか低下しませんでした.F-リゾチームの及ぼす成長の抑制は,単斜晶では正方晶に比べて非常に小さいことがお分かりいただけると思います.これらの結果は,予想通り,F-リゾチームが結晶表面に吸着しても,分子間接触の形成がほとんど抑制されないことを示しています.この結果は,単斜晶では蛍光ラベルが分子間接触部位から外れた位置に修飾されていることによります.
蛍光ラベルの分子サイズが小さいことからわかるように,単斜晶中では蛍光ラベルはリゾチーム分子間の空隙に位置しているものと考えられます(右下図).このことが,単斜晶の成長の抑制が正方晶に比べてずっと小さかった原因であります.単斜晶において,{101}および(010)面の成長の阻害にわずかな違いしか見られないという結果は,分子間接触形成時の蛍光ラベルによる立体障害は小さいを示しています.
 |
 |
|---|---|
| 単斜晶の面成長速度に及ぼすF-リゾチームの不純物効果.リゾチーム濃度:3.96 mg/ml,F-リゾチームの濃度:0.004 mg/ml (リゾチームに対して0.1%). | 単斜晶中の分子パッキングの模式図.蛍光ラベル5-TRITCはリゾチーム分子間の空隙に位置している.図では,蛍光ラベルの大きさは正確に表現されているが,向きは参考程度. |
6)F-リゾチームの実効分配係数について
最後に,F-リゾチームの正方晶および単斜晶に対する「実効分配係数」について考えてみたいと思います.実効分配係数K(eff)は次式で表されます.
K(eff)=[C(ic)/Cpc)]/[C(is)/C(ps)]
ここで,C(ic)およびCpc)は結晶中での不純物と目的タンパク質の濃度を,そして,C(is)およびC(ps)は溶液中での不純物と目的タンパク質の濃度を表します.我々の実験では,正方晶・単斜晶ともにC(is)/C(ps)=0.1%の条件で成長実験を行いました.また,成長後の結晶を溶解し,蛍光濃度を分析することで求めたK(eff)の値は,正方晶で2.9,斜方晶で3.2と,ほぼ同じ値を示しました.正方晶と単斜晶では,F-リゾチームのK(eff)値がほとんど同じであるにもかかわらず,成長阻害の程度は大きく異なることになります.この結果も,分子間接触の阻害が不純物効果において非常に重要な役割を果たすことを直接示す証拠となります.
F-リゾチームの分子構造はネイティブのリゾチームとほぼ同じであるため,両晶系でK(eff)の値が1よりも大きかったことは妥当であると考えられます.F-リゾチームがネイティブリゾチームと同様にステップにアプローチしうることに加えて,蛍光ラベルの疎水性が取り込み時に寄与したものと考えられます.これまでの研究では,リゾチーム正方晶系結晶に対するK(eff)値は,アセチル化リゾチームではK(eff)=2.2-3.4(B.R. Thomas, A.A. Chernov, J. Crystal Growth 232 (2001) 237),蛍光ラベル化リゾチームダイマーではK(eff)=0.5-1.2(Y. Iimura, et al, Cryst. Growth Des. 5 (2005) 301-305)と報告されています.F-リゾチームのK(eff)値がアセチル化リゾチームとほぼ同じであり,蛍光ラベル化リゾチームダイマーよりもずっと大きいという結果は,目的タンパク質と分子のサイズや構造がより似ている不純物タンパク質ほど目的タンパク質結晶に取り込まれやすいことを示しています.
7)その後の展開について
この研究の後,本ページで紹介した蛍光ラベル化リゾチームをプローブとして用いて,リゾチーム結晶表面上で蛍光1分子観察にもとづく下記の研究を進めてきました.投稿論文が受理され次第,順次ホームページでご紹介させていただきます(現在,完全に論文投稿律速の状態にあります,関係者の皆様ごめんなさい).ご期待ください.
(1)タンパク質結晶-溶液界面におけるタンパク質分子の拡散について,(2)タンパク質結晶表面へのタンパク質分子の吸着素過程について,(3)タンパク質結晶の不均一2次元核形成について,(4)タンパク質結晶表面への不純物タンパク質の吸着サイトと不純物効果について
(蛍光ラベル化リゾチーム・ページのトップへ)
To the top page of in-situ observation of protein crystallization; タンパク質結晶化過程のその場観察のトップページへ
To the top page; トップページへ,