レアアース
|
|
7月の第3月曜日は「海の日」で、今年の「海の日」は7月21日です。 「海の恩恵に感謝するとともに、海洋国日本の繁栄を願う」ことを趣旨として1995年に制定されました。 この日をきっかけに、海洋についての理解と関心を深めていきたいものです。 ・・・というわけで、今月は、海に関する話題として、「レアアース」を取り上げたいと思います。 今から14年前になりますが、2011年7月4日、 「日本最東端である南鳥島沖の海底に、レアアースの巨大鉱床が存在する。」 との発表がありました。 「レアアース」とは、元素の周期表において、 第3族元素であるスカンジウムとイットリウム、それにランタノイド15元素を合わせた、計17元素のことで、 これからのハイテク技術には欠かせない資源として、注目されています。 2009年の「レアアース・ショック」により、 レアアース市場は中国の思いのままか・・・と心配されたわけですが、 2011年のこの発表は、日本に希望の光を与えてくれるものでした。 現在、海洋研究開発機構(JAMSTEC)の地球深部探査船「ちきゅう」により、採掘法を検討中で、 2028年度の民間企業参入を目指しています。 さて、レアアースの巨大鉱床について、素朴な疑問が2つあります。 ①レアアースは、これからのハイテク技術に欠かせない・・・とのことですが、 他の元素と何が異なるのでしょうか? ②発見に至ったきっかけは、何だったのでしょうか?・・・最初からレアアース目的だったとは思えません。 そのような当たりハズレのある事案に研究予算は下りないでしょうからね。 ①は化学や物理学に関連します。 ②は地学に関連します。 今回は、まず、①について考えていきましょう! 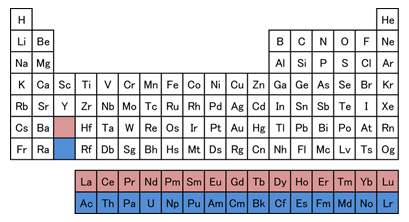 (図1) (図1)上の元素の周期表(図1)は、教科書に掲載されているもので、 ランタノイド(赤)とアクチノイド(青)は、欄外にはみ出ています。 この“はみ出し”を無くして、ランタノイドを第6周期の段に、アクチノイドを第7周期の段に入れると、 次のようになります(図2)。 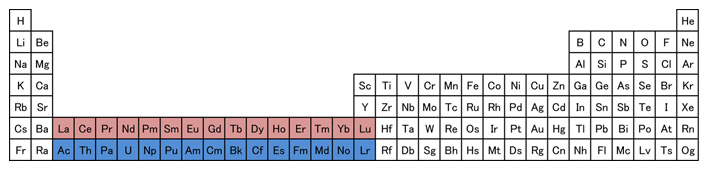 (図2) (図2)かなり横長になりました。 教科書では、スペースの都合上、この横長を避けて、図1のように描いているのでしょう。 この図2を見ると、ある特徴に気付きます。 第2・3周期、第4・5周期、第6・7周期というように、2段ずつ同じ元素数です。 第1周期には2×1=2種類の元素が、第2・3周期には2×(1+3)=8種類ずつの元素が、 第4・5周期には2×(1+3+5)=18種類ずつの元素が、 第6・7周期には2×(1+3+5+7)=32種類ずつの元素があります。 (1+3+5+7)というのは、電子軌道の種類と数を表しており、それぞれ、 「1」は“s軌道が1個”、「3」は“p軌道が3個”、「5」は“d軌道が5個”、「7」は“f軌道が7個” という意味です。頭にある「2×」の「2」は、それぞれの電子軌道に、電子は2個まで入ることを意味します。 どうして、電子が、こんな入り方をするのかは、物理で「量子力学」を学ぶと理解できます。 数学の「偏微分方程式」と併せて、一緒に学んでいきましょう! 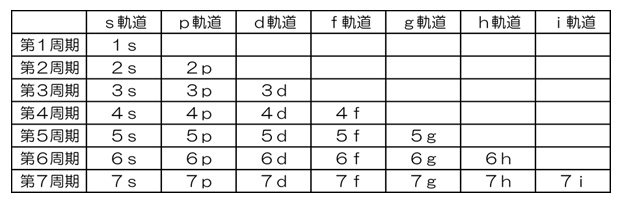 「第n周期に入ることができる電子の最大数は「2n2」であり、電子は内側から順番に入っていく。」 ・・・と教わります。 これに従うと、 一番内側の電子軌道は「1s」が1個であり、そこに電子が2個まで収まるので、 第1周期に、原子番号1の水素と、原子番号2のヘリウムが位置することが頷けます。 第2周期には8種類の元素がありますが、これは「2s」が1個と「2p」が3個で計4個の軌道があるからで、 原子番号3のリチウムから原子番号10のネオンが収まります。 第3周期の8元素は、1個の「3s」と3個の「3p」に順次収まっていった結果です。 この後、原子番号19のカリウムが「3d」軌道に収まっていくと思いきや、「4s」に収まります。 これは「マーデルングの規則」で説明されています。・・・詳しくは、塾にて♪ 「1s」→「2s」→「2p」→「3s」→「3p」→「4s」→「3d」→「4p」→「5s」→「4d」→ ・・・というように、右上から左下に斜めの線を引いていく順番になっています。 マーデルングの規則に従うと、ランタノイドの1つ手前であるバリウム(原子番号56)の時点で、 最外殻電子は6s軌道にありますが、1つ内側はもちろん、2つ内側の4f軌道も空白になっています。 ランタン以降のランタノイドでは、この(最外殻より2つ内側の)4f軌道に電子が入っていこうとするわけで、 この特殊な状況が、他の元素では代用できない最高の機能を生み出すことになるのです。  例えば「磁性(磁石としての性質)」について。 小学校で学ぶように、N極とS極という、相反する極どうしを近づけると、互いに引きつけ合います。 1つの電子軌道には、電子が2個まで入れるのですが、 ある軌道に入っている電子が2個ですと、互いに相殺されて、磁性がなくなります。 電子が1個しか入っていない軌道が多くあればあるほど、磁性は強くなります。 皆さんに「砂鉄」として馴染みある「鉄」は、原子番号が26なので、電子が26個あります。 最初の20個が、1sに2個、2sに2個、2pに6個、3sに2個、3pに6個、4sに2個と入って、 次の5個が、5つある3d軌道に1つずつ入ります。 最後の1個は、既に1つずつ埋まった3d軌道5つのどれかに入ります。 したがって、電子が1個しか入っていない軌道が4つ存在するので、磁性がある程度強いわけです。 ちなみに、鉄の1つ前にあるマンガン(原子番号25)の場合、電子1個の3d軌道が5つになるので、 より磁性が強くなるんじゃないの?・・・と思いたくなりますが、 5つの3d軌道がすべて同じ(副殻が満たされた)状況になると、逆に安定して、磁性が弱まります。  レアアースのガドリニウム(Gd)は、原子番号が64で、電子が64個あります。 1sに2個、2sに2個、2pに6個、3sに2個、3pに6個、4sに2個、3dに10個、4pに6個、 5sに2個、4dに10個、5pに6個、6sに2個・・・この時点で56個。 あと8個は4f軌道へ。 7つある4f軌道のそれぞれに1個ずつ入った後、最後の1個は、5dに入ります。 こうなると、電子が1個しか入っていない軌道が8つも存在することになり、磁性がかなり強くなります。 もちろん、最後の電子1個の振舞いは、気ままで、瞬間的には4fの1つに入ることも多々あるでしょうが、 それでも、電子が1個しか入っていない軌道が6つあるので、やはり磁性が強くなります。 同じ磁力の磁石を作るとき、磁性のより強い金属を用いると、それだけ少量で済み、 その分、磁石がコンパクトになります。 今まで持ち運べなかった機器が、簡単に持ち運べるサイズになるかも知れません。 デスクトップの大きなパソコンだと、家に居る時しか使えませんが、 “小さなパソコン”であるスマホだと、手軽に持ち運べて、家以外でも使えます。 これを実現したのもレアアース。 ここに挙げた「磁性」以外にも、光学的な性質など、レアアースは多方面で大活躍しそうです。 |
|
|