Prameters to control
supersaturation of proteins and their mechanisms;
タンパク質の過飽和度を制御する因子とそのメカニズム
タンパク質の良質で大型の単結晶を成長させるためには,結晶化過程において過飽和度を注意深く制御しなくてはなりません.そのためには,タンパク質の溶解度に影響を及ぼすpH,温度,イオン強度,沈殿剤の種類や濃度,さらには圧力などの操作因子を制御する必要があります.本ページでは,これらの因子とタンパク質の溶解度との関係をまとめてみました.なお,このページは,下記の本中にまとめた内容を,よりわかりやすく?したものです.ですので,このページに限ってのみ,転載不可とさせていただきます.
(第4章1節 タンパク質結晶の成長原理と戦略設定,佐藤清隆 (ed.),結晶成長のダイナミクス; 第6巻 溶液成長,共立出版,2002. )
1)pH
皆様よくご存じのように,タンパク質分子の表面は,親水性(極性)のアミノ酸からなる部分と,疎水性(非極性)のアミノ酸からなる部分とからなっています.親水性のアミノ酸は周囲の水と強く結合して,タンパク質の水への溶解を助けています.なかでも側鎖に正の電荷を持つアミノ酸(リジン,アルギニン,ヒスチジン)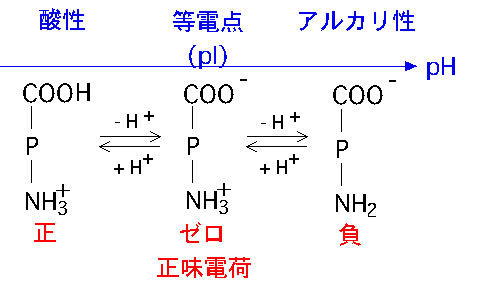 および負の電荷を持つアミノ酸(グルタミン酸,アスパラギン酸)の解離状態は,溶液のpHに強く依存しています.正の電荷と負電荷の数が等しく,タンパク質の正味電荷がゼロとなる等電点よりも酸性のpHでは正味電荷は正になり,逆にアルカリ性側では負になります.正味電荷が正もしくは負の時は,タンパク質分子間に働く静電的反発力により,溶解状態が安定となります.それに対して,等電点近傍では互いの静電的反発力が最小となり,タンパク質の溶解度が最も小さくなるため,結晶化しやすくなります.つまり,正味の表面電荷がゼロの等電点でタンパク質の溶解度は最小となり,それからpHが離れると共に溶解度は増加します.
および負の電荷を持つアミノ酸(グルタミン酸,アスパラギン酸)の解離状態は,溶液のpHに強く依存しています.正の電荷と負電荷の数が等しく,タンパク質の正味電荷がゼロとなる等電点よりも酸性のpHでは正味電荷は正になり,逆にアルカリ性側では負になります.正味電荷が正もしくは負の時は,タンパク質分子間に働く静電的反発力により,溶解状態が安定となります.それに対して,等電点近傍では互いの静電的反発力が最小となり,タンパク質の溶解度が最も小さくなるため,結晶化しやすくなります.つまり,正味の表面電荷がゼロの等電点でタンパク質の溶解度は最小となり,それからpHが離れると共に溶解度は増加します.
2)温度
タンパク質結晶の溶解は一般に吸熱過程です.そのため低分子化合物と同様に,一般にタンパク質の溶解度も温度が上がると増加します.しかしそれは,タンパク質の分子表面が親水的(hydrophilic)である場合であり,逆に分子表面が疎水的(hydrophobic)な場合には,温度の上昇と共に溶解度が減少する場合も見られます.疎水的表面近傍の水は,水分子が水素結合でつながったクラスレートと言われる結晶状の多面体を形成しており,分子表面の疎水的部分はクラスレートによるかごの中に閉じ込められているため溶解状態でいられると考えられています.したがって,温度上昇により水の分子運動が活発になり,クラスレート構造が破壊されると溶解度は減少することになります.このような疎水的構造化による水のエントロピーの減少(熱力学的不利)は,タンパク質を構成するアミノ酸のうち疎水的なアミノ酸は分子内部に閉じ込められ,親水的なアミノ酸が表面に配置される原動力であります.結晶化の過程においても,分子同士が凝集する際に疎水的表面をできるだけ隠そうとする作用が働きます.そのため,結晶よりもアモルファス状の沈殿物の方が,疎水的表面を多く水に露出させている場合が多く,結晶は温度上昇に伴い溶解するが,沈殿物は温度を低くするほど溶解する場合も多く見られます.
3)イオン強度
タンパク質水溶液への種々の塩の添加は,溶解度に大きな影響を及ぼします.一般にタンパク質の溶解度は,添加した塩の濃度が比較的低い場合には塩濃度と共に増加し,塩濃度が高い領域では逆に塩濃度と共に減少します.前者を塩溶(salting-in),後者を塩析(salting-out)と呼びます.本段落では,タンパク質の結晶化において最も頻繁に試される手段である塩溶・塩析について述べてみたいと思います.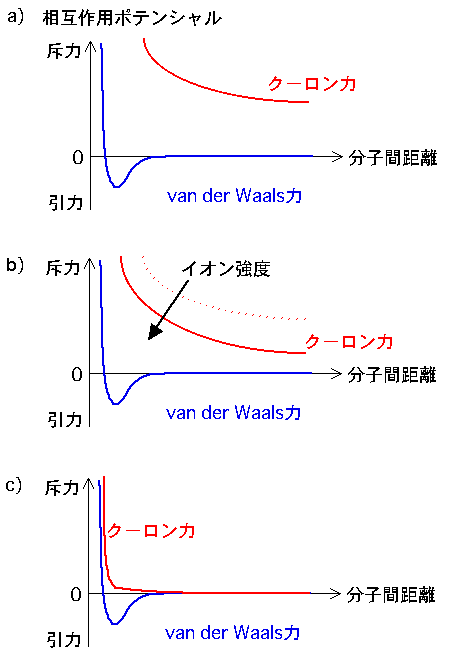
塩溶は,タンパク質を均一な表面電荷を持つコロイド粒子とみなし,Debye-H歡kel理論で表される非特異的な静電相互作用で説明することができます.タンパク質分子間に働く相互作用ポテンシャルを右図に示しました.青線は電気的に中性な分子間に働く相互作用ポテンシャルで,引力部分はファン・デル・ワールス相互作用に相当します.また,赤線は表面電荷による反発力のみを考えたクーロン相互作用を示します.
図中のaは純水中のクーロン相互作用で,遠方にまで静電反発力が及んでいる様子を示します.ファン・デル・ワールス相互作用による引力よりも静電反発力のほうがずっと強いため,分子間にはトータルとしては強い斥力が働いていています.しかしながら,あまりに斥力がきついため,あまりタンパク質分子同士が近寄ることができず,あまり多くの量,溶解することができません.
それに対し,bに,塩を少し加えた低イオン強度でのクーロン相互作用を示します.塩を加えたことによりクーロン相互作用が静電遮蔽を受け,反発力が及ぶ領域が短くなっています.そのため,aの場合に比べてbでは分子同士がさらに接近でき,同じ体積中により多くの分子が溶解できるようになるため溶解度が増大します.これが「塩溶効果」であると考えられています.
さらに塩を加えると,cに示したようにクーロン反発力はさらに静電遮蔽されるため,近距離力であるファン・デル・ワールス力が顔を出し,分子間に引力が働き出します.そのため,分子同士は凝集し固相が生成するため溶解度は減少してゆきます.これが「塩析効果」であると考えられています..
しかしながら,塩析については,上記の説明以外に,加えた塩がタンパク質を溶解している水を取り去ることによっておこるとする考えもあります.この考えによりますと,水和数および水和力が大きなイオンほど塩析能力が高い事が予想されます.しかしながら,塩析能力の目安を示すものにHofmeister系列(SO42->HPO42->CH3COO->citrate3->HCO3->CrO3->Cl->NO3->ClO3>Li+>Na+>K+>NH4+>
Mg2+)がありますが,必ずしもその順序に従わない例も多く報告されています.そのため,塩析能力はイオンの水和能力のみで評価することはできません.塩溶・塩析操作は古くから行われている古典的な方法ですが,まだそのメカニズムに関しては不明な点が多いのが現状です.
4)沈殿剤(有機溶媒や非荷電ポリマー)
タンパク質の溶解度を減少させるために加える試薬のことを,一般的に沈殿剤と呼びます.塩類を沈殿剤として用いた際のタンパク質の溶解度変化については,3)ですでに述べました.塩類の他にも,よく用いられる沈殿剤としてエタノールやアセトンなどの有機溶媒,およびPEG
(polyethylene glycol)のような非荷電ポリマーがあります.ここではそれらの作用機構について考えてみます.
水は大きな誘電率を持ちます(25℃での比誘電率78.3)ため,水よりも誘電率の小さな物質(25℃での比誘電率,アセトン:20.7,エタノール:24.6)を混合すると,水溶液の誘電率は低下します.そのため,タンパク質分子の表面電荷によるクーロン反発力が,より遠方まで届くようになり,同じ体積中により少ない分子しか溶解できなくなるため溶解度は減少します.上記の説明以外に,加えた沈殿剤によって水溶液の疎水性が増すため,タンパク質の親水的な分子表面の溶解度が減少し,結果としてタンパク質の溶解度が減少するという考えもあります.有機溶媒の添加は,タンパク質の変成(denaturation)を防ぐために,一般に低温(0℃以下)で行われます.アセトンやエタノール以外に,よりタンパク質を変成させにくい沈殿剤としてDMSO
(dimethyl sulfoxide)が注目されています.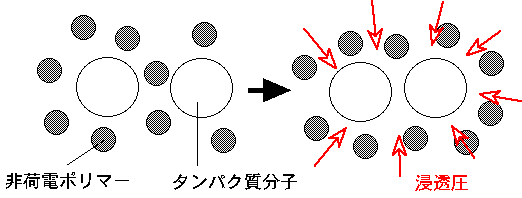
現在,塩類以外に最も多く用いられている沈殿剤は,ポリエチレン・グリコール(PEG)でしょう.PEGなどの非荷電ポリマーを沈殿剤として用いた場合には,上述の誘電率や疎水性によるタンパク質の溶解度低下効果に加えて,排除体積効果が働きます.PEGなどのポリマーは,水溶液中で大きな体積を占めます.そのため,図に示したようにタンパク質分子間に,立体障害効果によってポリマーが入り込めないような空間が生じます.そうすると,そのような領域とポリマーが溶解している領域との間に浸透圧が働き,タンパク質分子は会合しようとして,溶解度が下がります.非荷電ポリマーを沈殿剤として使用する場合には,ポリマーがタンパク質を変性させないこと,および結晶相中に入り込まないことが利点として挙げられます.一般に,分子量がより大きなポリマーを用いるほど,沈殿剤としての能力は高くなります.
5)圧力(静水圧)
上記の1)から4)はタンパク質の溶解度の操作パラメータとして古くから知られ良く用いら得ています.しかしながら,圧力(静水圧)もタンパク質の結晶化を制御するためのパラメータとして非常に優れたものであることが近年明らかにされてきています.
ですので,構造生物分野の方々には非常に目新しく映ると思いますが,有効な方法ですので,機会があれば,試されてみてください.
タンパク質の溶解度が,なぜ圧力の変化によって左右されるのでしょうか? ルシャトリエの法則で説明できます.「系に外部から変化を与えると,その変化を解消する方向に,平衡が移動する
」というアレです.圧力の場合には,タンパク質分子が水和する(タンパク質結晶が溶ける),およびタンパク質分子が脱水和する(成長する)際の「体積」がキーポイントになります.
もし,タンパク質分子が水和された邦画系全体の体積が小さくなれば,圧力の増加と共に溶解度は増加しまし,逆の場合には逆の結果になります.
結晶中では,水和水は2種類に分けて考えることができます.1)分子間接触部位の水和水:結晶中ではタンパク質分子同士は特定の部位で互いに接触し,相互作用しあっています.結晶が溶ける際には,そのような分子間接触部位が新たに水和されることになります.2)結晶中でも水和されている部位の水和水:タンパク質結晶中のタンパク質分子間には大きな空隙があるため,タンパク質の分子間接触部位ではない部分の分子表面は,結晶内部においても水和されています.このような水和水は,圧力効果には関与しません.すなわち,1)の分子間接触部位の水和水と,バルク溶液中の自由水との体積の違いが,圧力効果をもたらすことになります
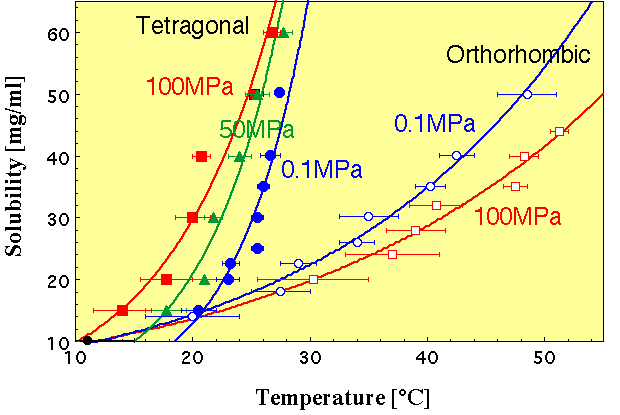
| これまでに,リゾチームの正方晶および斜方晶,ズブチリシン,ソーマチン,グルコース・イソメラーゼについて,高圧力下での溶解度が詳細に測定されています.しかし,溶解度の圧力依存性は,リゾチームの正方晶(正)および斜方晶(負),ズブチリシン(正),ソーマチン(負),グルコース・イソメラーゼ(負)というように一般則はありません.しかし,どの様な性質の分子間接触部位を持つタンパク質がどの様な挙動を示すかを詳細に解析することにより,まだ不明な部分が多い「タンパク質の水和」の問題を明らかにすることができるはずです.すなわち,高圧力はタンパク質の水和についてアプローチするための,本質的には優れた手段になるはずです.そのような研究をこれから系統的に進めていこうと思っております. |
|
|
G. Sazaki, et al., J. Crystal Growth, 196, 204 (1999).
|
高圧力は,溶解度のみでなく,成長カイネティクスなどにも顕著な影響を及ぼします.それらについては,下記の論文や解説を参考にしてください.
1)宮下 哲ら,日本結晶成長学会誌,26, 192-202 (1999).
2)沢田 勉,2.2 圧力の印加効果,佐藤清隆 (ed.),結晶成長のダイナミクス; 第6巻 溶液成長のメカニズム; 構造と形のデザイン (共立出版,東京,
2002).
3) 鈴木良尚ら,日本高圧力学会誌,13, accepted.
ここまで長々と拙文を読んでくださいまして誠に有り難うございます.是非ともご批判,サジェスチョンなどくださいますよう御願い申し上げます.
To the top page; トップページへ,
To the top page of protein crystal
growth; タンパク質結晶成長のトップページへ
 および負の電荷を持つアミノ酸(グルタミン酸,アスパラギン酸)の解離状態は,溶液のpHに強く依存しています.正の電荷と負電荷の数が等しく,タンパク質の正味電荷がゼロとなる等電点よりも酸性のpHでは正味電荷は正になり,逆にアルカリ性側では負になります.正味電荷が正もしくは負の時は,タンパク質分子間に働く静電的反発力により,溶解状態が安定となります.それに対して,等電点近傍では互いの静電的反発力が最小となり,タンパク質の溶解度が最も小さくなるため,結晶化しやすくなります.つまり,正味の表面電荷がゼロの等電点でタンパク質の溶解度は最小となり,それからpHが離れると共に溶解度は増加します.
および負の電荷を持つアミノ酸(グルタミン酸,アスパラギン酸)の解離状態は,溶液のpHに強く依存しています.正の電荷と負電荷の数が等しく,タンパク質の正味電荷がゼロとなる等電点よりも酸性のpHでは正味電荷は正になり,逆にアルカリ性側では負になります.正味電荷が正もしくは負の時は,タンパク質分子間に働く静電的反発力により,溶解状態が安定となります.それに対して,等電点近傍では互いの静電的反発力が最小となり,タンパク質の溶解度が最も小さくなるため,結晶化しやすくなります.つまり,正味の表面電荷がゼロの等電点でタンパク質の溶解度は最小となり,それからpHが離れると共に溶解度は増加します.